Chirurgie du méningiome cérébral chez le chien et le chat
Dr Antoine BERNARDÉ (CHV Saint-Martin)
1. Introduction
Les tumeurs cérébrales sont tantôt primaires (principalement méningiomes et gliomes chez le chien, et méningiomes chez le chat), ou secondaires à des cancers variés, principalement carcinomateux. L’incidence des néoplasies intra-crâniennes est de 14,5 pour 100000 chiens, et de 3,5 pour 100000 chats. Dans les deux espèces, le méningiome, issu des leptoméningocytes, est la tumeur primaire la plus fréquente. Bien que les méninges enveloppent également la moelle épinière, la localisation des méningiomes est plus souvent cérébrale que médullaire.
Chez le chien, le méningiome cérébral est le plus souvent une tumeur solitaire, située le plus souvent dans le parenchyme des lobes frontaux, la faux du cerveau (le sillon interventriculaire dorsal) ou à la jonction entre le cervelet et le pont du tronc cérébral. Sa croissance est lente chez le chien, expliquant sa découverte souvent tardive (croissance lente = adaptation cérébrale = peu de signes cliniques associés). Des métastases sont possibles dans 18 à 27% des cas. La tumeur est souvent friable et ses contours se démarquent difficilement du tissu cérébral normal.
Chez le chat, la tumeur est le plus souvent solitaire (multiple dans 14,5% des cas), à croissance lente également, et ne métastase généralement pas. Le tissu tumoral, très ferme, se distingue généralement bien du tissu cérébral normal. Elle est plus superficielle, sur la convexité cérébrale, et est donc plus facilement accessible au chirurgien vétérinaire. Elle peut s’accompagner d’hyperostose (Figure 1).
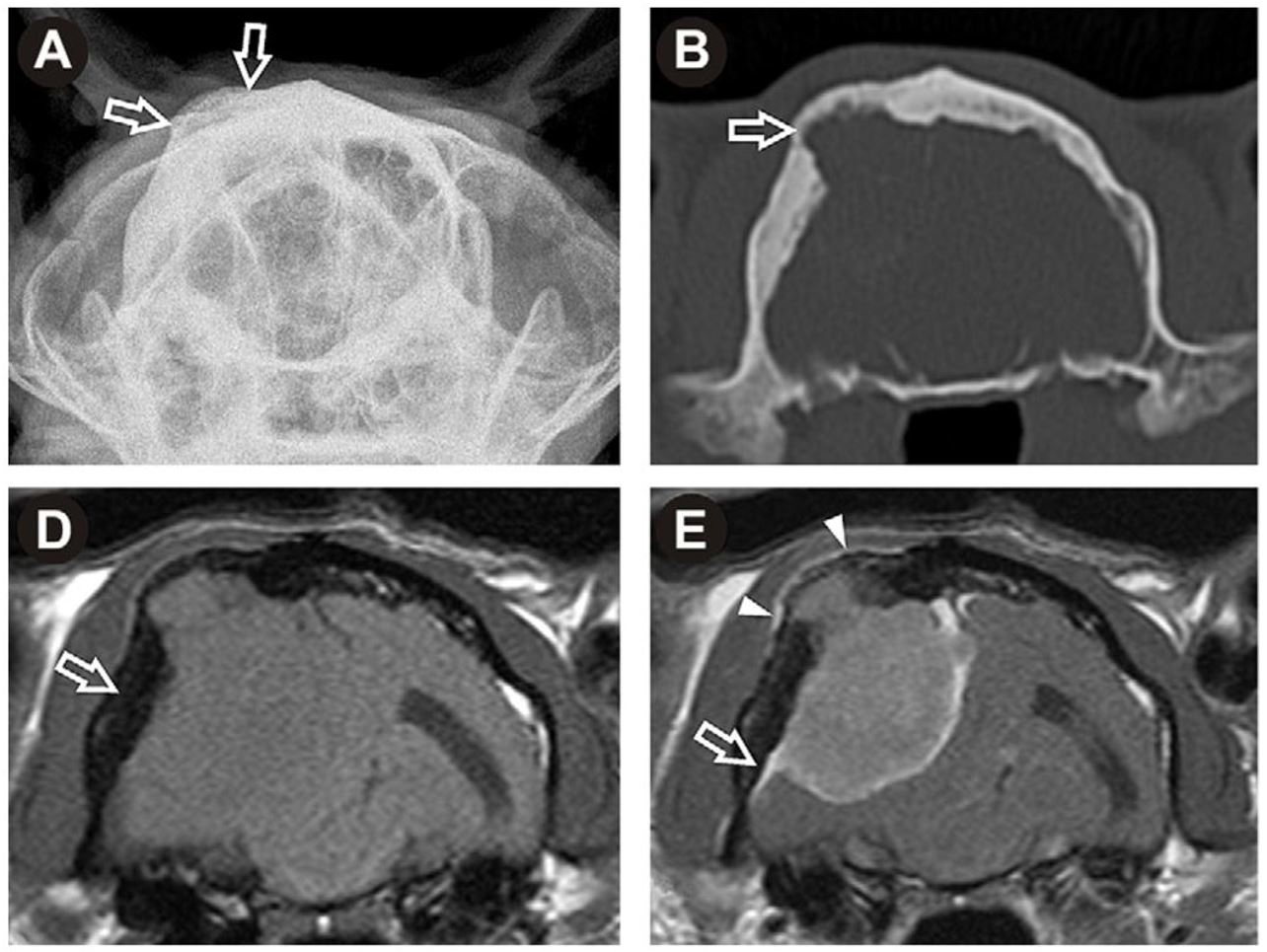
Figure 1 : hyperstose associé à un méningiome chez un chat
Les chiens affectés sont plus souvent âgés de plus de 5 ans, dolicocéphales, de sexe femelle. Golden Retriever, Boxer, et Dobermann sont souvent citées comme races prédisposées (le boxer étant aussi concerné par les gliomes). Chez le chat, il s’agirait plus souvent de mâles, de 3 à 18 ans avec une moyenne à 12 ans, sans prédisposition raciale.
Les signes cliniques débutent par des modifications comportementales plus ou moins frustes (désorientation, léthargie, agressivité), faiblesse. Des parésies locomotrices, une tête penchée, des troubles de la vision, des convulsions et altérations de la conscience sont souvent plus tardives. La perte de vision est souvent rapportée chez le chat. On note une perte de poids malgré un appétit conservé, des dysorexies, dysdypsies, quelquefois de la bradycardie. Outre des troubles comportementaux et moteurs, on note une altération des nerfs crâniens, principalement du V (perte de sensibilité oculaire), du VII (hyporeflexie palpébrale et ptose des babines), du VIII (tête penchée, nystagmus, ataxie). Les déficits des nerfs crâniens caractérisent plutôt une lésion du tronc cérébral, les convulsions plutôt des lésions du cerveau antérieur, du cortex et du thalamus. La rapidité d’installation et la sévérité des signes cliniques sont généralement corrélées à une durée de survie plus courte.
2. Diagnostic
La biochimie et l’hématologie sanguines ne montrent pas de modification spécifique. Les chats affectés de méningiomes sont souvent FeLV négatifs. L’analyse du LCS est généralement normal chez le chat, alors qu’une protéinorrachie, une numération leucocytaire augmentée avec plus de 50% de neutrophiles, et des cellules tumorales sont découvertes chez 50 à 60% des chiens. La cellularité en globules blancs très augmentée est considérée chez le chien comme un facteur pronostic défavorable. L’absence de proteinorrachie ou neutrophilie n’exclut pas une tumeur cérébrale.
Le diagnostic différentiel des tumeurs cérébrales inclut tous les désordres cérébraux évolutifs, congénitaux (hydrocéphalie principalement, encéphalose hépatique accompagnant les shunts porto-systémiques) et acquis (abcès, méningites, toxoplasmose, néosporose, traumatismes, troubles métaboliques, etc…). Le diagnostic définitif repose sur l’imagerie et/ou la biopsie.
L’imagerie radiologique est de peu d’intérêt sauf à mettre en évidence l’hyperostose ou l’érosion osseuse qui peuvent accompagner certains méningiomes du chat. Les moyens d’imagerie avancés (Scanner et IRM) sont requis pour décrire la localisation et la taille du méningiome et planifier son traitement. Le scanner est un examen moins onéreux et souvent plus rapide à réaliser que l’IRM. On pourra le préférer si l’animal ne peut supporter une anesthésie longue. En revanche, pour les lésions du tissu nerveux l’IRM est beaucoup plus sensible. Elle permet une meilleure différenciation des tissus normaux et lésés, et assure une distinction plus nette de l’œdème et du tissu tumoral. L’IRM doit être préférée systématiquement lors de suspicion d’atteinte de la région infra-tentorielle, des artefacts nombreux empêchant une bonne évaluation par le scanner de cette région chez les animaux domestiques. Un méningiome se présente sous la forme d’une masse extra-axiale, c’est-à-dire qui se développe à l’extérieur du tissu nerveux. Son contour est souvent bien délimité. Sur un scanner, le méningiome est habituellement iso ou spontanément hyperdense avant injection de produit iodé. En IRM, il apparaît hypo à iso-intense en T1 et hyperintense en T2. Après injection de produit de contraste (Iode en scanner, Gadolinium en IRM), le rehaussement est habituellement intense, homogène ou hétérogène. Des calcifications peuvent être présentes au sein de la tumeur. De même, il n’est pas rare d’observer des zones cavitaires à contenu liquidien, correspondant à un foyer nécrotique ou à une accumulation intra-tumorale de liquide. L’effet de masse exercé sur les structures voisines dépend de la taille et de la localisation de la masse. Un œdème parfois important accompagne souvent ces tumeurs et augmente l’intensité des symptômes. Les méningiomes par leur position périphérique ont souvent une base large tournée vers l’os du crâne situé en regard. Il est commun d’observer une hyperostose ou au contraire un amincissement de l’os en regard, surtout chez le chat. Enfin, une prise de contraste méningée (« queue durale, dural tail ») peut être observée, très évocatrice de méningiome. La localisation la plus fréquente est supra-tentorielle, mais des cas sont décrits en région cérébelleuse.
3. Traitements du méningiome cérébral
Le traitement médical est destiné à réduire les effets secondaires de la tumeur cérébrale résultant de l’œdème péri-lésionnel, l’augmentation de la pression intra-crânienne, les convulsions. Il repose sur la corticothérapie, les diurétiques de l’anse ou osmotique, les anti-convulsivants. Des avancées récentes ont été faites dans le domaine de la chimiothérapie de certaines tumeurs cérébrales, mais peu effectives en cas de méningiome.
La chirurgie et la radiothérapie, avec ou sans chirurgie, sont les options thérapeutiques d’actualité en cas de méningiome.
Le méningiome du chat est généralement complètement excisable chirurgicalement, et la procédure chirurgicale peut s’avérer curative sans traitement adjuvant. Si la tumeur ne peut pas être excisée complètement ou récidive, une nouvelle excision couplée à une radiothérapie est recommandée. Toutefois, nous avons rencontré 2 cas avec survie asymptomatique de 26 mois pour le premier, et de plus de 2 ans pour le second toujours en vie, malgré récidive prouvée (dont un avec extension extra-crânienne). Chez le chien, la chirurgie permet rarement une excision complète (tumeur plus profonde nécessitant une dissection intra-durale, et démarcation circonférentielle moins évidente). La radiothérapie de cytoréduction est souvent préférée chez le chien, à moins que la tumeur semble superficielle.
Préparation du patient :
Méthylprednisolone Sodium Succinate (15 à 30 mg/Kg) + Furosémide (1 mg/Kg IV) ou Mannitol (1 g/Kg IV sur 15 minutes) sont distribués 30 minutes avant l’induction anesthésique. Une supplémentation en oxygène et une fluidothérapie IV sont mises en place. Le glucose étant le seul nutriment énergétique du cerveau, la glycémie est surveillée et maintenue autour de 1,0 g/L au besoin.
Anesthésie :
Induction : Diazepam (0,2 mg/Kg IV) + Propofol (4-6 mg/Kg IV ou en titration). Le Propofol (comme le faisaient les barbituriques) diminue la perfusion et le risque d’hypertension cérébrale, et diminue la consommation cérébrale en oxygène. La kétamine et l’acépromazine sont contre-indiqués, l’un favorisant l’hypertension cérébrale, l’autre les convulsions.
Hyperventiler le patient sous O2 pendant quelques minutes avant d’administrer l’agent d’anesthésie volatile contribue à diminuer le CO2, la perfusion cérébrale et le risque d’hypertension intra-crânienne.
Maintenance avec isoflurane ou sévoflurane exclusivement, à concentration minimale efficace.
Ventilation modérée (contrôle oxymétrique et capnographique : maintenir C02 entre 28 et 35 mm Hg)
Monitorer la pression artérielle qui doit rester au-dessus de 60 mm Hg.
Surveiller la fréquence cardiaque et le risque de bradycardie sinusale. Se tenir prêt à injecter de l’Atropine (0,3 mg/Kg IV) si la bradycardie est avérée.
Analgésie :
Opioïdes autorisés (morphine, fentanyl). La Morphine peut être administrée en bolus (0,3 mg/Kg toutes les 4 heures) ou en perfusion continue (0,5 à 0, 7 mg/Kg/h). Le Fentanyl est administré en perfusion continue 10 à 20 µg/kg/h par voie IV en perfusion continue après une dose de charge en bolus (5 à 10 µg/kg IV) pendant la phase opératoire.
Antibioprophylaxie versus antibiothérapie :
L’antibiothérapie n’est recommandée qu’en cas d’abord trans-sinusal, frontal. Dans tous les autres cas, on se contentera d’une antibioprophylaxie.
Position du patient et voies d’abord :
Voir article sur les voies d’abord de la boite crânienne.
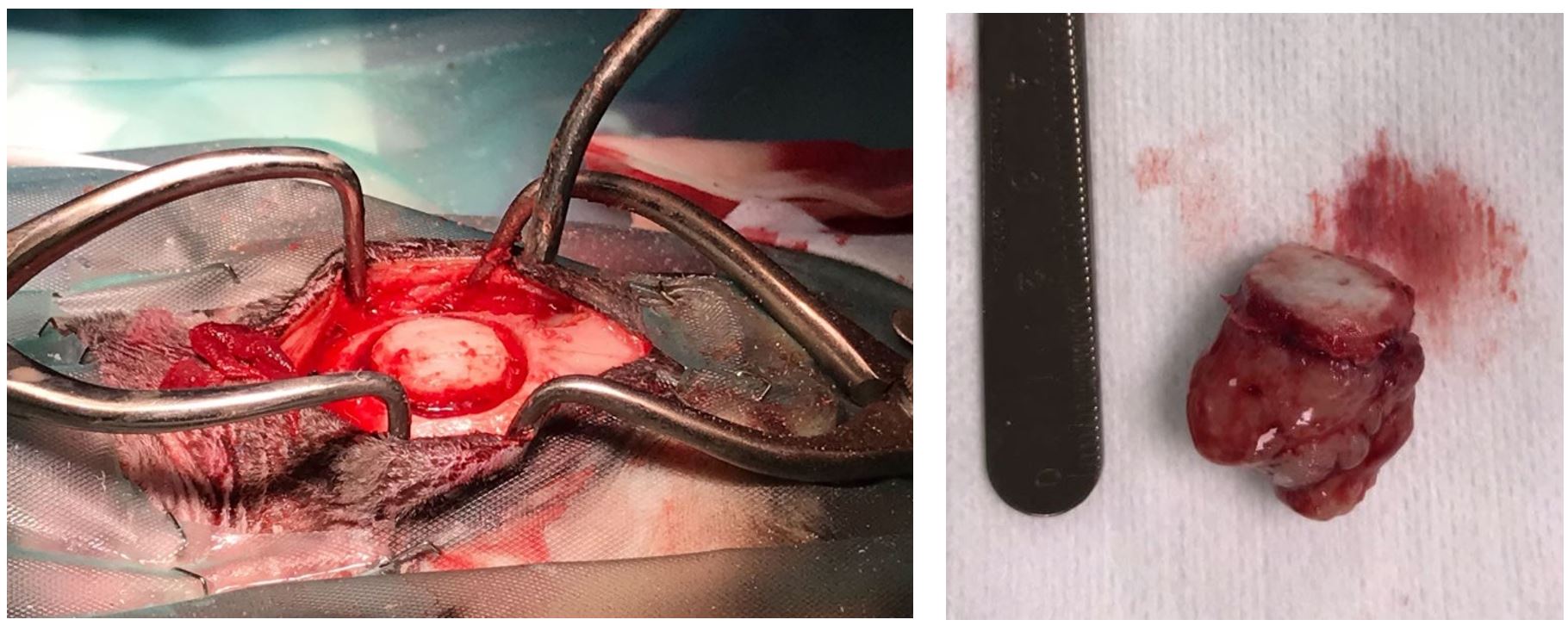
Règles spécifiques au retrait du méningiome
Tumeur méningée = contamination méningée. La dure- mère ne doit pas être gardée pour être remise en place en fin d’anesthésie.
Méningiome du chat = contamination osseuse fréquente : le volet osseux ne doit pas être replacé en fin de chirurgie. La dure-mère est remplacée par un segment de fascia temporal, ou un neuro-patch, éventuellement recouvert d’une compresse hémostatique de type Pangen ou Surgicel. La craniectomie proprement dite est fermée par apposition musculaire (abord rostrotentoriel de petites dimensions < 3 cm) ou une prothèse de polyméthylméthacrylate (PMMA) (voir article sur les voies d’abord de la boite crânienne).
4. Pronostic
Du point de vue histologique, ces tumeurs sont généralement de bas grade, d’évolution lente et peu invasives (notamment chez le chat). La gravité de l’affection résulte surtout de la localisation de la masse dans un milieu clos qu’est la boîte crânienne, engendrant des signes cliniques souvent dramatiques du fait de la compression du parenchyme cérébral. Le pronostic de récupération de l’animal est considérablement amélioré après intervention chirurgicale.
La durée de vie moyenne en cas de traitement médical palliatif (corticoïdes, anticonvulsivants), est de 60 à 80 jours chez le chien, et 20 jours chez le chat.
Après chirurgie, la durée de vie moyenne rapportée est de 7 à 40 mois chez le chien, et de 24 à 37 mois chez le chat.
Chez le chien, on gagne 5 à 16 mois lors de radiothérapie isolée; 16,5 lors de chirurgie complétée par des séances de radiothérapie; 30 mois lors de chirurgie associée à une chimiothérapie (Hydroxyurée) chez quelques cas décrits.
Le facteur pronostique le plus important à prendre en considération est la nature histologique (sous-type) du méningiome. Ainsi, les méningiomes transitionnels, psammomateux et méningothéliaux, sont de meilleur pronostic que les autres sous-types.
Une étude rétrospective multicentrique publiée en 2015 (Vet Surg 2015;44 :772-776) décrit les caractéristiques et durées de survie de 121 chats opérés pour méningiome intra-crânien entre 1994 et 2011 aux Etats-Unis. 76 chats étaient de sexe mâle, castrés, sans prédisposition raciale. Âge médian de 12 ans (3 à 18 ans). La durée médiane des signes cliniques avant chirurgie était de 1,25 mois (1 à 23 mois), ces signes étant changement de comportement, ataxie, convulsions, déficits visuels, marche sur le cercle, et parésie. 7 chats (6%) sont morts en période péri-opératoire (<1 mois) et 9 chats (7%) sont morts ultérieurement, la cause du décès étant en rapport avec le méningiome. La durée médiane de survie (évaluable chez 67 chats seulement puisque 54 cas n’ont pas pu être suivis) a été de 37 mois.
La mortalité péri-opératoire est donc faible et la durée de survie peut atteindre ou dépasser 3 ans chez le chat. Même en cas de récidive, le pronostic n’est pas forcément défavorable à court-terme : la figure ci-dessous illustre le cas d’un chat (non voyant) de 12 ans opéré en janvier 2017 d’un méningiome temporal au CHV St Martin chez lequel on constate une récidive du méningiome lors d’un contrôle scanner effectué 9 mois plus tard (octobre 2017) avec extension dans le muscle temporal. Ce chat était toujours vivant, et asymptomatique en mars 2020.
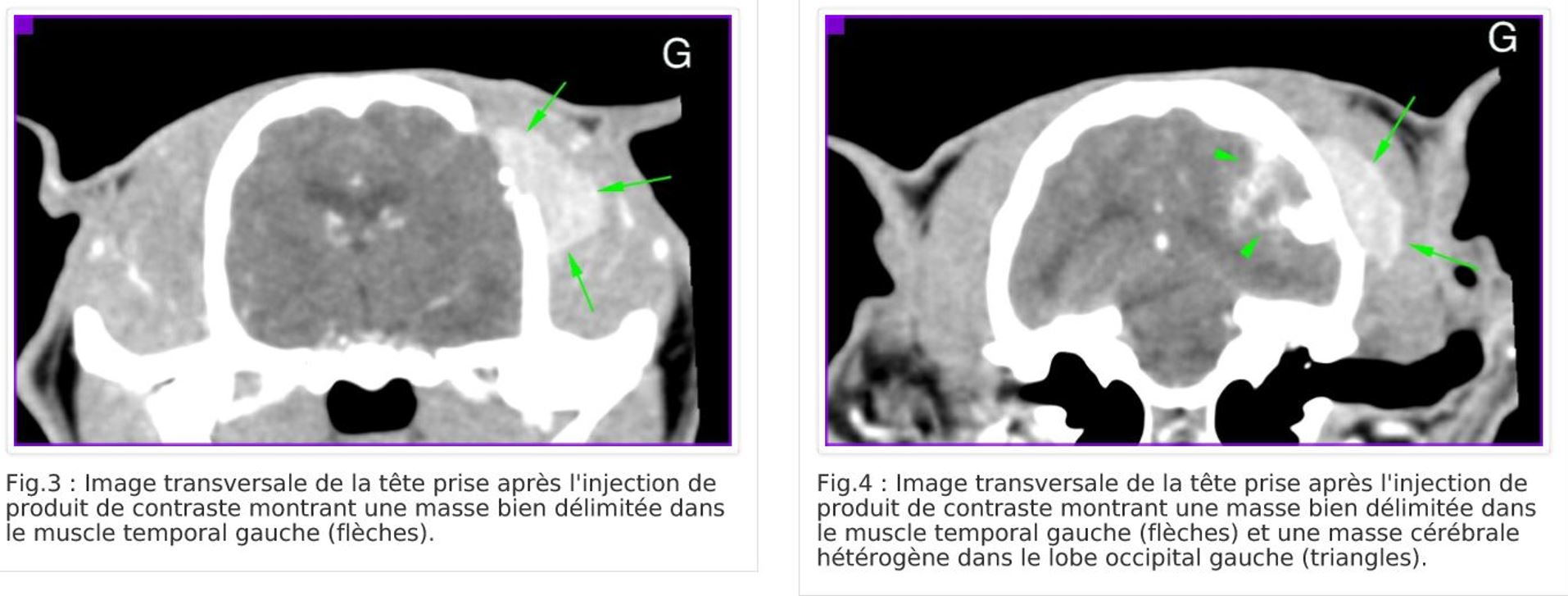
CONCLUSION
Le méningiome du chat est souvent accessible au traitement chirurgical, avec un taux de mortalité péri-opératoire faible et une durée médiane de survie autour de 3 ans, sans traitement adjuvant. Chez le chien, le pronostic est nettement moins favorable, et la radiothérapie, associée ou non à la chirurgie, est préférée.
