Un cas d’encéphalose hépatique chez un husky
Dr Olivia VINCENT, Dr Anne-Charlotte BARROT (CHV Saint-Martin)
Mushu, chien mâle castré Husky de 2 ans et demi est présenté en consultation pour l’investigation de changements de comportement durant quelques minutes à plusieurs heures, d’apparition aléatoire sans événement associé. Durant un épisode, le propriétaire rapporte que Mushu semble désorienté, déambule sans but, est hyporéactif aux stimuli de son environnement et présente du ptyalisme. Le propriétaire décrit une récupération complète entre les épisodes et aucun autre signe clinique associé. Le chien avait déjà présenté un évènement du même type dans son plus jeune âge, mais les épisodes ont repris récemment et semblent s’accentuer en intensité et fréquence.
Mushu est correctement médicalisé et ne reçoit actuellement aucun traitement.
Examen clinique :
L’examen clinique général de Mushu est sans anomalie, avec un score corporel de 6/9, une auscultation cardio-pulmonaire sans anomalie, des muqueuses roses, un temps de remplissage capillaire inférieur à 2 secondes, une palpation abdominale souple. Mushu est normotherme, et le reste de l’examen est dans les valeurs usuelles.
Examen neurologique :
Lors de la consultation, son état de conscience est altéré, il ne répond pas au stimuli de son environnement et semble désorienté. Il déambule sans but. L’examen des nerfs crâniens et les réflexes médullaires ne présente aucune anomalie. La réponse à la menace est cependant ralentie.
Bilan clinique :
- Altération de l’état de conscience
- Absence de réponse aux stimuli extérieurs chez un jeune chien
Ses signes sont en faveur d’une encéphalose hépatique. Une atteinte cérébrale parait peu probable.
Examens complémentaires :
Un bilan sanguin complet a été réalisé. Le bilan biochimique est sans anomalie, à l’exception des ALAT augmentées à 254 U/L. L’hémogramme met en évidence une anémie modérée à 21,5% d’hématocrite, normocytaire normochrome arégénérative.
Les acides biliaires pré-prandiaux ont été dosés et sont augmentés à 152,8 micromol/L (< 30 micromol/L), ce qui suggère une diminution de la fonction hépatique. Le dosage des acides biliaires post-prandiaux n’a donc pas été fait.
Le dosage de l’ammoniac dans le sang est également très augmenté à 213 micromol/L (0-98), ce qui confirme l’encéphalose hépatique.
Au vu du son âge, un shunt portosystémique congénital est fortement suspecté.
Après réalisation d’un lavement rectal avec du lactulose et une stabilisation médicale par un changement alimenta ire et la mise en place de métronidazole (7,5mg/kg BID), lactulose (0,5mL/kg/BID) et levetiracetam (15mg/kg/TID) pendant une semaine, un examen tomodensitométrique est réalisé avec injection de contraste iodé. La lecture des images permet de conclure à la présence de multiples shunts extra-hépatiques acquis en périphérie de la veine rénale gauche, associés à une diminution de volume du foie plus marquée du côté droit indiquant une probable hépatopathie chronique.
Figure 1, 2 et 3 : Multiples shunts extra-hépatiques acquis en périphérie de la veine rénale gauche
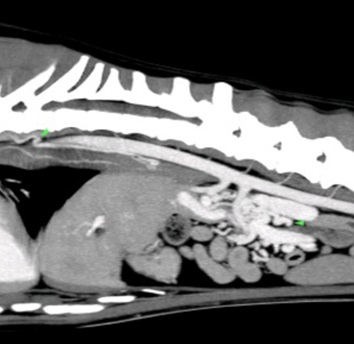
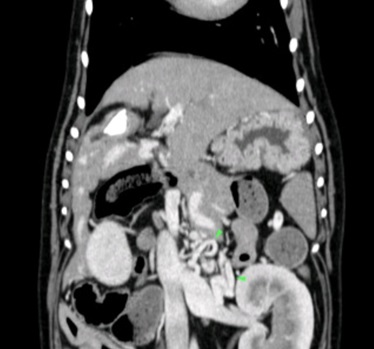
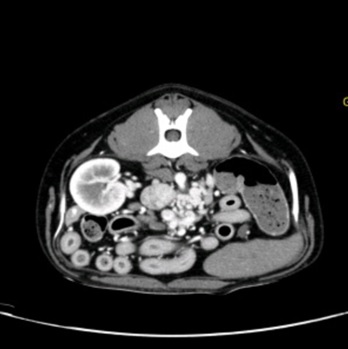
Des biopsies hépatiques ont été recommandées pour préciser le diagnostic mais non souhaitées par le propriétaire.
BILAN
Lors de shunts hépatiques acquis, l’indication n’est pas chirurgicale. Seule une gestion médicale à vie permet de limiter les risques d’encéphalose hépatique et traiter si possible l’affection hépatique. Le pronostic reste cependant réservé à court- moyen terme. Notre cas était encore en vie 3 mois après le diagnostic.
DISCUSSION
Les shunts porto-systémiques (SPS) sont des communications vasculaires anormales entre la circulation porte et la circulation veineuse systémique, court-circuitant le foie. Ils s’observent aussi bien chez les chiens que chez les chats. Il existe des shunts congénitaux présents à la naissance et des shunts acquis qui se sont développés suite à une hypertension portale. Les shunts acquis sont multiples. A la différence, les shunts congénitaux sont, dans la plupart des cas, uniques.
Pour notre cas, malgré son jeune âge et l’apparition précoce des signes, les shunts portosystémiques sont acquis. Au moment du diagnostic, l’affection hépatique à l’origine de l’hypertension portale est souvent au stade terminal (fibrose importante ou cirrhose).
1. Rappel :
Le foie possède de nombreuses fonctions.
Le foie métabolise et/ou excrète des substances exogènes (drogues, toxines). Il joue un rôle essentiel dans le métabolisme protéique en synthétisant les protéines et en convertissant l’ammoniac toxique (NH3) en urée non toxique. Il joue également un rôle important dans le métabolisme lipidique (en synthétisant le cholestérol, les lipoprotéines…), ainsi que dans le métabolisme glucidique (en stockant le glycogène et réalisant la gluconéogénèse…).
Le foie joue un rôle central dans la coagulation en synthétisant la majorité des facteurs de coagulation.
2. Les signes cliniques d’insuffisance hépatique :
A. L’encéphalose hépatique (EH):
a. Pathogénèse :
L’EH est définie comme une dysfonction neurologique causée par une maladie hépatique et/ou un SPS et s’observe quand plus de 70 % de la fonction hépatique est perdue. La pathogénèse de l’EH n’est pas totalement connue.
L’ammoniac (NH3) est produit par la flore gastrointestinale. En absence de problème hépatique, le foie convertit l’ammoniac en urée et glutamine via le cycle de l’urée. L’urée est moins toxique que l’ammoniac et est éliminée par les reins. Lors de SPS, l’ammoniac n’est pas converti en urée et passe dans la circulation systémique, puis au niveau du système nerveux central. L’ammoniac a un rôle central dans l’EH mais la sévérité de l’EH n’est pas en lien avec la concentration du NH3. Le NH3 n’est pas le seul acteur de l’EH. En dehors du NH3, les toxines impliquées dans l’EH sont : les acides gras à court chaine, le tryptophane, les acides biliaires, les benzodiazépines endogènes, l’acide gamma-aminobutyrique,…
Le NH3 est la molécule la plus facile à mesurer et le traitement pour diminuer le NH3 semble réduire la gravité des signes cliniques d’EH.
b. Signes cliniques d’encéphalose hépatique :
Les signes cliniques (SC) d’EH peuvent varier d’anomalies comportementales subtiles jusqu’au coma. Ils incluent une léthargie, une ataxie, une désorientation, une amaurose, des crises épileptiformes, et le coma. Dans 30 à 50 % des cas, les signes neurologiques sont en lien avec le repas.
Pour notre cas, le lien avec les repas n’a pas été rapporté. Les signes cliniques étaient fluctuants et épisodiques car l’encéphalose hépatique était chronique.
B. Les signes gastrointestinaux :
Des signes gastro-intestinaux (vomissements, diarrhée, anorexie, pica et/ou méléna, hématémèse) sont présents chez 30 % des chiens et n’étaient pas rapportés pour notre cas.
C. Les signes urinaires :
La polyuro-polydipsie peut être observée lors de shunt bien qu’elle ne corresponde pas au motif de consultation. Elle est due principalement à une polydipsie psychogénique (secondaire à l’EH) ainsi qu’à la perte de concentration médullaire (secondaire à la diminution de l’urée).
Les SC urinaires sont plus fréquemment des SC du bas appareil urinaire tels que pollakiurie, hématurie, strangurie, obstruction urinaire. Ses SC sont dus à la formation de calculs d’urate. Ils se forment secondairement à la diminution de production d’urée, l’augmentation d’excrétion d’ammoniac et à la diminution du métabolisme de l’acide urique. Ils sont présents dans environ 30 % des cas et peuvent être à l’origine d’infection du tractus urinaire.
Chez notre patient, des calculs ont été mis en évidence au scanner, sans signe clinique.
D. Autres signes :
D’autres signes liés à la maladie hépatique primaire peuvent être présents également.
3. Diagnostic :
1- Médical :
Bien que l’imagerie médicale soit nécessaire pour confirmer la présence de shunt porto-systémique ainsi que de le localiser, certains tests permettent de renforcer notre suspicion clinique.
A. Bilan sanguin : (2)
L’hémogramme peut mettre une évidence une anémie légère microcytaire normochrome non régénérative. Une séquestration du fer dans les cellules de Kupffer est suspectée en être la cause. La cause de l’anémie chez notre patient était probablement plus secondaire à la condition inflammatoire. Une leucocytose peut être observée secondaire à une formule de stress ou à une mauvaise élimination bactérienne hépatique et est un facteur pronostic négatif.
Sur le bilan biochimie, l’activité des enzymes hépatiques (phosphatase alcaline (PAL), alanine aminotransférase (ALT), aspartate aminotransférase (ASAT), γ- glutamyltransférase (GGT)) peut être normale à modérément augmentée. Cependant, les marqueurs de fonction hépatique sont fréquemment modifiés. Chez les chiens, les changements les plus fréquents sont l’hypoalbuminémie (50 %), une diminution de l’urée (70 %), l’hypocholestérolémie, ainsi que l’hypoglycémie, ce qui n’était pas le cas pour notre patient.
B. Analyse d’urine :
La densité urinaire peut être diminuée lors d’insuffisance hépatique. Elle peut être iso- (1.008-1.012) ou hypo-sthénurique (< 1.007).
Des cristaux d’urate sont fréquemment présents (26-57 % chez chien). Une protéinurie peut être observée probablement secondaire à une sclérose glomérulaire. L’analyse d’urine n’a pas été réalisée chez notre patient car le propriétaire ne l’a pas souhaité.
C. Tests de fonction hépatique :
a. Les acides biliaires :
Les acides biliaires sont synthétisés à partir du cholestérol par les hépatocytes. Ils sont ensuite excrétés dans les canaux biliaires, puis stockés dans la vésicule biliaire. Suite à un repas provoquant la contraction de la vésicule biliaire, ils sont libérés dans le duodénum où ils participent à la digestion des lipides. Ils sont réabsorbés au niveau de l’iléon distal et transportés jusqu’au foie via la circulation porte. Sans anomalie hépatique, plus de 95 % des acides biliaires sont réabsorbés par le foie. L’augmentation des acides biliaires s’observe lors d’anomalie vasculaire notamment de SPS, lors de cholestase ou lors de maladie du parenchyme hépatique.
Il est recommandé de tester les acides biliaires pré-prandiaux et post-prandiaux. Une première prise de sang doit se faire après un jeun de 12h. Suite à cette prise de sang, un petit repas est donné (une cuillère à café d’une pâté riche en lipides et protéines pour les petits chiens suffit). La deuxième prise de sang se fera 2 heures après le repas. Attention, l’hémolyse peut modifier les résultats.
La sensibilité et la spécificité des acides biliaires sont de 93 % et 67 % respectivement chez le chien. Pour notre patient, comme les acides biliaires pré-prandiaux étaient augmentés, les acides biliaires post-prandiaux n’ont pas été réalisés.
b. L’ammoniac :
Le test doit se réaliser après 6 à maximum 12 heures de jeûne. Il est important d’analyser l’échantillon dans les 30 minutes car l’ammoniac est labile. La prise de sang doit se faire sur tube hépariné, puis mis dans la glace pendant quelques minutes. Le sang est ensuite centrifugé et analysé immédiatement. L’hémolyse peut augmenter faussement l’ammoniémie. Un dosage normal de l’ammoniémie ne permet néanmoins pas d’exclure une insuffisance hépatique.
Attention, chez l’Irish Wolfhound, il existe une hyperammoniémie chez les jeunes sans shunt hépatique, et qui disparaît à l’âge de 3-4 mois.
2- Par imagerie médicale :
L’imagerie permet non seulement de confirmer la présence ou infirmer d’un shunt, mais aussi de le localiser et d’identifier d’autres anomalies associées (modifications hépatiques (microhépatie), vaisseaux portes et hépatiques peu ou pas visibles, rénomégalie, lithiases rénales et/ou vésicales).
L’angio-scanner est devenu l’examen d’imagerie de choix. Très sensible et spécifique, il permet de visualiser précisément l’arborisation portale, et de mettre ainsi en évidence la présence de shunts (acquis ou congénital).
3- Prise en charge thérapeutique :
Le traitement d’une insuffisance hépatique associée à des shunts acquis est uniquement médical. Le traitement médical a pour but de diminuer les signes cliniques mais ne traite par la cause et n’empêche pas la détérioration de la fonction hépatique.
A. Nutritionnelle
Comme la production d’ammoniac est en lien avec l’apport de protéines, une restriction protéique est recommandée.
B. Médicale :
Le changement alimentaire seul ne permet pas de limiter les signes cliniques d’encéphalose hépatique. Il doit être associé à la mise en place d’un traitement médical. Celui-ci doit être mis en place le plus tôt possible.
Le lactulose a plusieurs effets bénéfiques. Son effet laxatif permet de faciliter l’évacuation de toxines digestives dont l’ammoniac. De plus, le lactulose acidifie le colon ce qui entraine une ionisation de l’ammoniac NH3 en ion ammonium NH4+ qui ne peut pas être absorbé au niveau digestif. Le changement de pH du colon a également un effet sur la flore intestinale, en diminuant celle-ci. Le lactulose est administré à la posologie de 0,25 à 0,5 mL/kg 2 à 3 fois par jour par voie orale. Cette dose est à adapter selon la consistance des selles qui doivent être molles mais moulées.
Une antibiothérapie à visée digestive doit également être mise en place pour limiter la flore intestinale à l’origine de la production d’ammoniac. Plusieurs antibiotiques peuvent être utilisés : le métronidazole 7,5 mg/kg 2 fois par jour ou l’amoxicilline 10 mg/kg 2 fois par jour ou la néomycine 22 mg/kg 2 fois par jour. Ils peuvent être utilisés en cure de 2-3 semaines toutes les 4 à 8 semaines ou en continu.
Pour notre patient, seul le traitement de l’encéphalose hépatique a été mis en place car les biopsies hépatiques n’ont pas été souhaitées par le propriétaire.
Le pronostic est réservé à court-moyen terme lors d’insuffisance hépatique associée à de multiples shunt acquis.
RÉFÉRENCES BIBLIOGRAPHIQUES
- Adam G. Gow. Hepatic Encephalopathy. Vet Clin North Small Anim 47 (2017) 585-599.
- Berent AC. Portosystemic vascular anomalies. Vet Clin Small Anim. 2009 ; 39 : 513-541.
- Buob S, Johnston AN, Webster CRL. Portal hypertension: pathophysiology, diagnosis, and treatment. Vet Intern Med. Mar-Apr 2011;25(2):169-86.
- Lidbury JA, Cook AK, Steiner JM. Hepatic Encephalopathy in dogs and cats. J Vet Emerg Crit Care 2016; 26(4):471-87.
- Ruland K. et coll. Sensitivity and specificity of fasting ammonia and serum bile acids in the diagnosis of portosystemic shunts in dogs and cats. Vet Clin Pathol. 2010 ; 39 : 57-64.

