Comment prendre en charge l’otite à Malassezia chez le chien ?
Dr Emilie VIDEMONT-DREVON (CHV Saint-Martin)
Quelle cause primaire rechercher, comment savoir si le nombre de levures est excessif et quels traitements mettre en place sont autant de question que doit se poser le vétérinaire lors de la mise en évidence de Malassezia à l’examen cytologique du cérumen.
Introduction
Les otites externes constituent un motif de consultation fréquent en consultation vétérinaire.
Elles sont multifactorielles et font intervenir des causes primaires et secondaires, ainsi que des facteurs prédisposant et aggravant. L’identification de ces différents causes et facteurs est indispensable pour aboutir à une guérison.
Pathogénie
Les levures du genre Malassezia font partie de la flore commensale cutanée et muqueuse de la majorité des mammifères et oiseaux. Bien que 18 espèces aient actuellement été décrites, Malassezia pachydermatis prédomine très largement chez le chien. Ces levures sont, fréquemment, retrouvées, chez le chien sain, dans les conduits auditifs. Leur nombre est plus élevé dans certaines races, telles que West Highland White Terrier, Setter anglais, Shih Tzu, Basset Hound, Cocker Américain, Boxer, Teckel, Caniche, Cavalier King Charles, Berger Allemand et Silky Terrier Australien.
Une différence de pathogénicité existerait entre les levures issues d’oreilles saines et d’oreilles enflammées.
Il est important de se rappeler que la mise en évidence de Malassezia en excès dans les oreilles ne constitue qu’une cause secondaire d’otite, qui aggrave l’inflammation dans une oreille anormale. Cela doit donc systématiquement conduire à rechercher une cause primaire, qui induit une otite dans une oreille saine (tableaux 1 et 2).
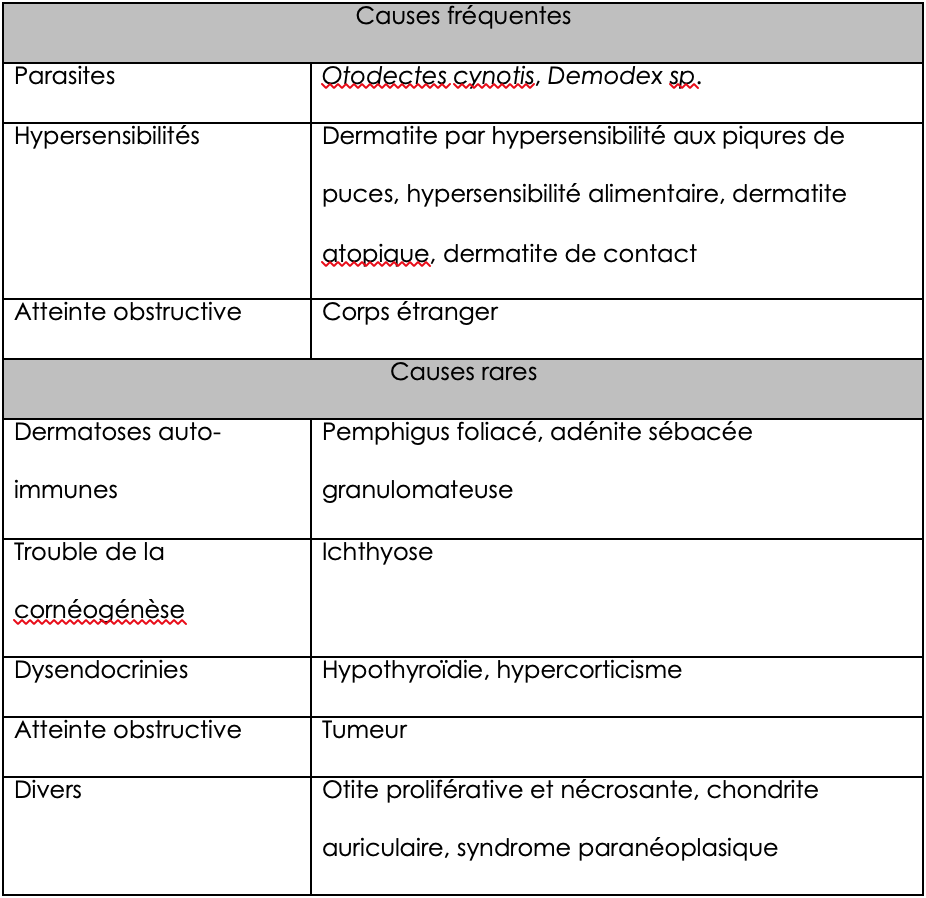
Tableau 1 : causes primaires d’otite chez le chien
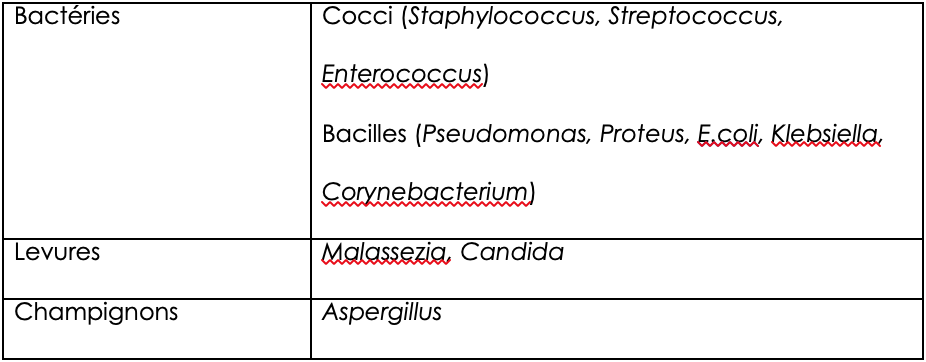
Tableau 2 : causes secondaires d’otite chez le chien
Une prolifération de Malassezia dans les oreilles est, le plus souvent, secondaire à une dermatose par hypersensibilité : dermatite par hypersensibilité aux piqûres de puces, hypersensibilité alimentaire ou dermatite atopique. Il est maintenant clairement admis que les chiens atopiques hébergent plus de levures que les chiens sains : des levures sont ainsi isolées par culture fongique dans 63.4 % des conduits auditifs de chiens atopiques (Nardoni 2007). Une otite érythémato-cérumineuse récidivante avec prolifération secondaire de Malassezia peut, parfois, être l’unique manifestation d’une dermatose par hypersensibilité (Zur 2011).
L’identification de facteurs prédisposants et aggravants est également indispensable. Les premiers augmentent le risque d’otite sans à eux seuls pouvoir déclencher l’inflammation auriculaire, les seconds empêchent la résolution de l’otite (tableaux 3 et 4).
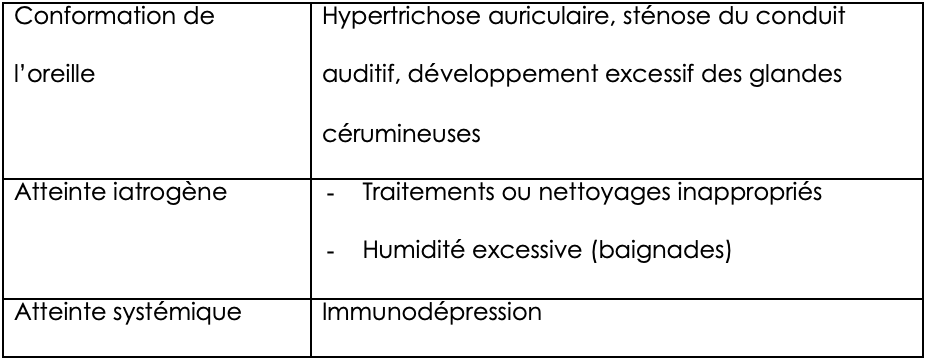
Tableau 3 : facteurs prédisposants
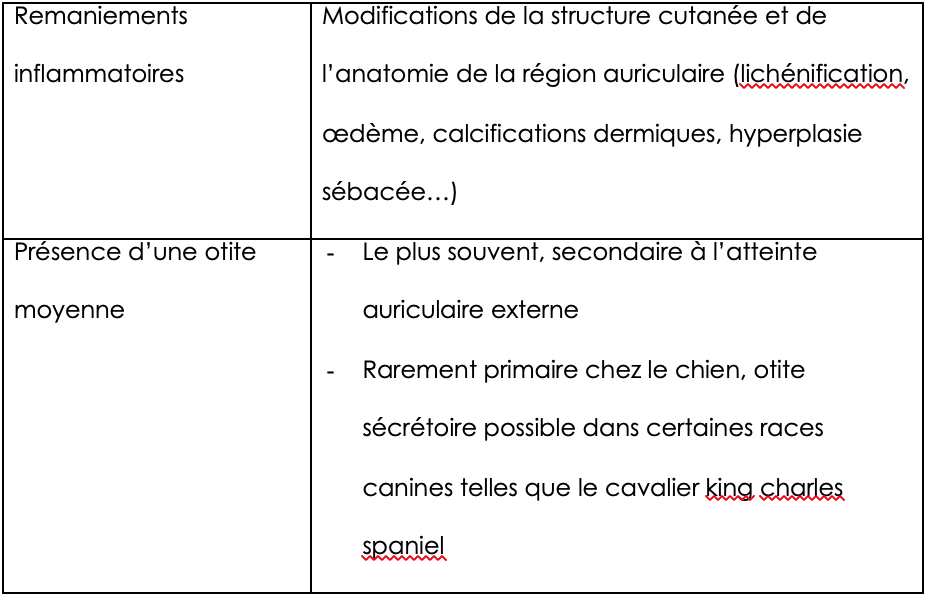
Tableau 4 : facteurs perpétuants
Signes cliniques associés
Une prolifération de Malassezia dans les oreilles est, le plus fréquemment, associée à une otite érythémato-cérumineuse, malodorante avec un érythème, une séborrhée et une lichénification marqués (Photo 1). Le prurit est souvent important.
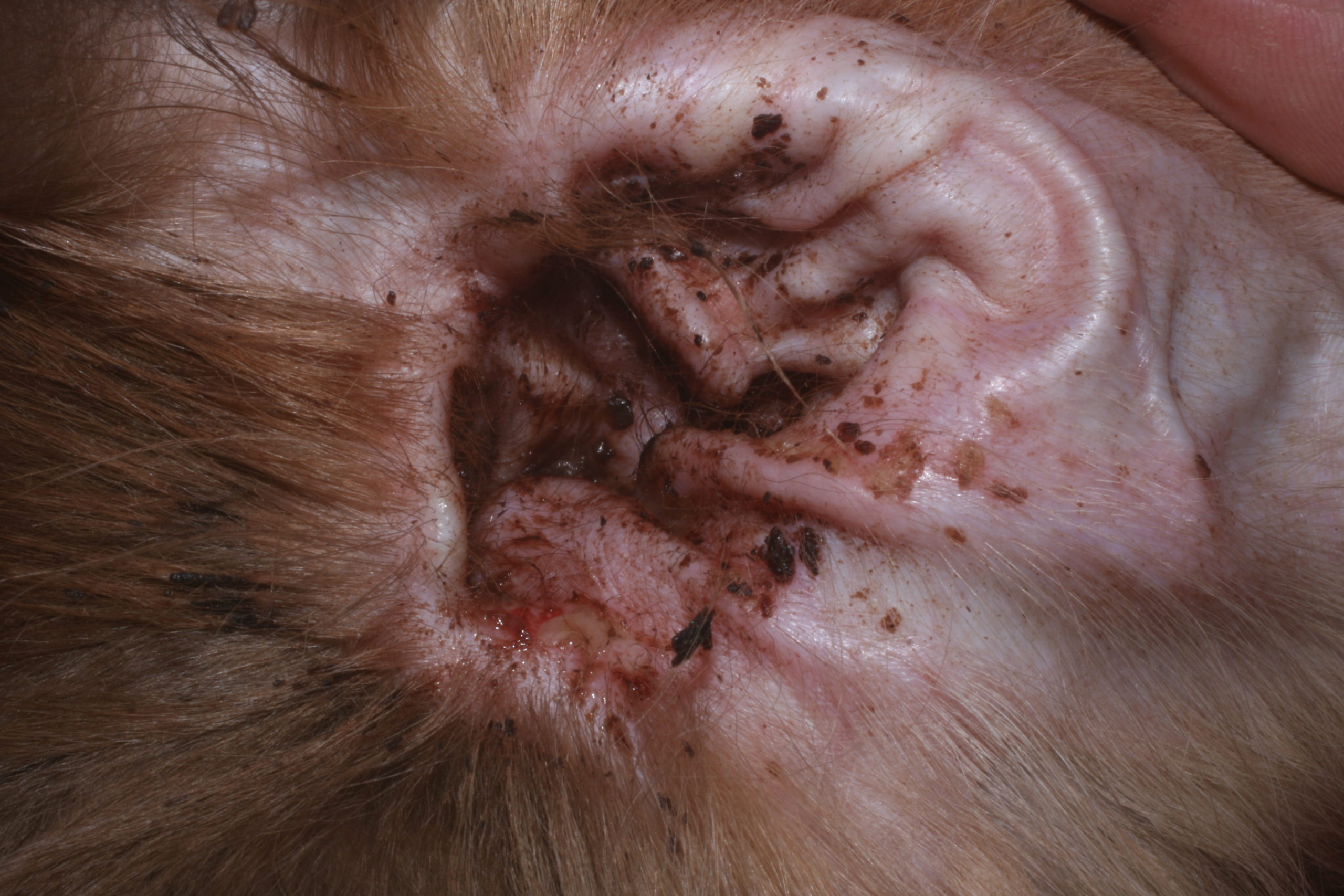
Photo 1 : otite érythémato-cérumineuse associée à une prolifération de Malassezia
Une dermatose prurigineuse, érythémateuse et séborrhéique, souvent malodorante, localisée ou généralisée, concomitante, peut être présente. L’atteinte des pavillons auriculaires est fréquente.
Mise en évidence des Malassezia
La mise en évidence de Malassezia dans les oreilles s’effectue, le plus souvent, par écouvillonage (Photo 2). Un écouvillon est introduit dans le conduit auditif puis roulé sur une lame porte-objet. Une méthode alternative est d’aspirer l’exsudat à partir du conduit horizontal à l’aide d’un tube en caoutchouc, permettant ainsi de collecter le matériel accumulé dans la partie distale du conduit auditif (Choi 2018).

Photo 2 : cérumen obtenu par écouvillonnage et étalé sur une lame port-objet, avant coloration
La lame est ensuite colorée à l’aide d’un kit de coloration rapide. Une coloration uniquement avec le bleu de méthylène a été proposée. La fixation préalable du cérumen par la chaleur ne semble pas influencer la mise en évidence de levures (Toma 2006). Au microscope, Malassezia pachydermatis mesure 2 à 7 μm et a un bourgeonnement unipolaire qui lui confère un aspect en « bouteille de Perrier » ou en cacahuète.
Peu d’études se sont intéressées à la quantification du nombre de levures dans les oreilles. Une étude de 2002, comparant la cytologie auriculaire de 24 chiens présentant une otite externe à celle de 37 chiens sains, a montré que l’on pouvait observer jusqu’à 2 Malassezia par champ à l’immersion chez les chiens sains. L’observation de plus de 5 Malassezia par champ à l’immersion peut être considérée comme anormale (Ginel 2002) et ce seuil est retenu le plus souvent (Photos 3 à 5). Notons toutefois que cela mériterait d’être confirmé à plus large échelle et que le diagnostic reste basé, sur des signes cliniques compatibles, la mise en évidence de levures à l’examen cytologique et la réponse – clinique et cytologique – au traitement.

Photo 3 : cytologie auriculaire chez un chien sain, moins de 2 Malassezia sont observées par champ à l’immersion
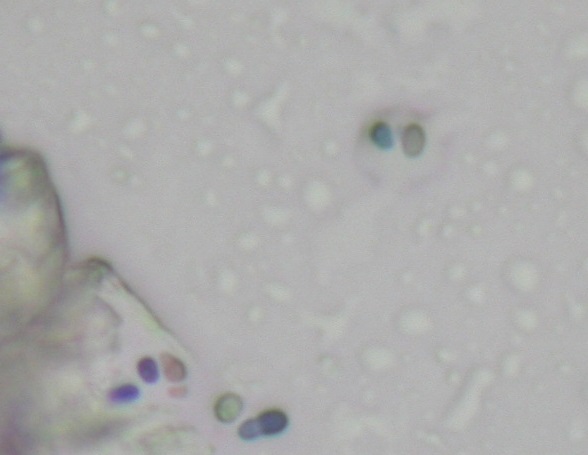
Photo 4 : cytologie auriculaire chez un chien atopique sans otite, entre 2 et 5 Malassezia sont observées par champ à l’immersion
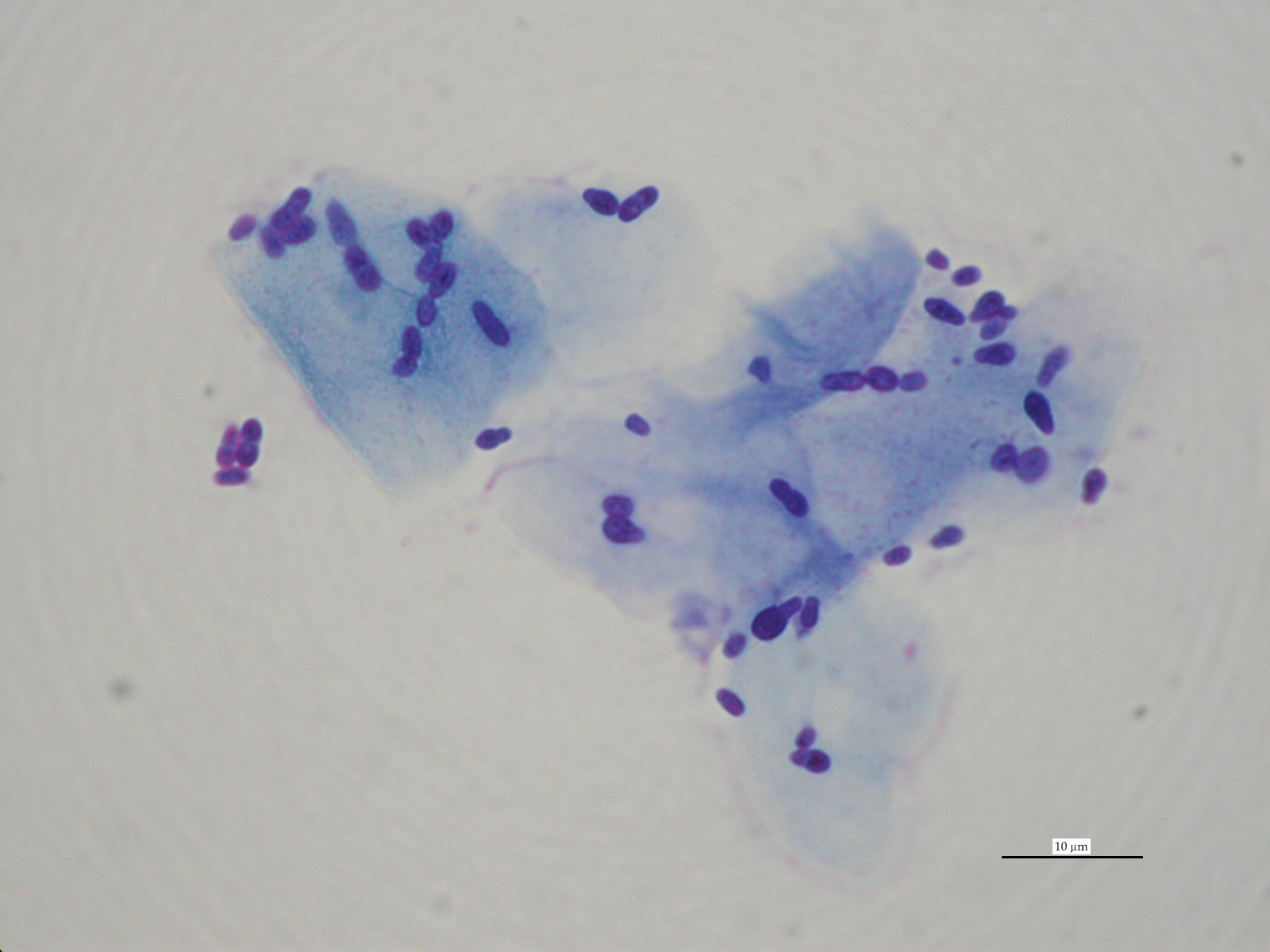
Photo 5 : cytologie auriculaire chez un chien souffrant d’otite à Malassezia, plus de 5 Malassezia sont observées par champ à l’immersion
Des techniques récentes, telles qu’une PCR quantitative, émergent et permettraient d’identifier avec une meilleure sensibilité que l’examen cytologique une prolifération anormale de levures dans les oreilles et de suivre la réponse au traitement (Puig 2019).
La culture fongique est essentiellement réalisée dans le cadre d’études et présente peu d’intérêt en pratique courante, des levures étant présentes chez la majorité des animaux.
Traitement
La prolifération de Malassezia dans les oreilles n’étant que secondaire, seul le traitement spécifique de la cause primaire permet d’aboutir à la guérison. Cette prolifération, ainsi que les facteurs perpétuants et aggravants doivent néanmoins être systématiquement recherchés et corrigés (Kennis 2013).
1. Correction de la cause sous-jacente
Les proliférations auriculaires de Malassezia compliquent, souvent, une dermatose par hypersensibilité. Un diagnostic allergologique différentiel doit être instauré : traitement antiparasitaire renforcé, régime d’éviction, recherche des immunglobulines E spécifiques des aéroallergènes dans le sang ou le derme des chiens atopiques.
La correction de l’inflammation associée aux dermatoses par hypersensibilité peut permettre d’annuler les conditions favorables à la prolifération des levures dans les oreilles. Lorsque l’atteinte auriculaire est isolée, l’instillation auriculaire d’un dermocorticoïde peut être intéressante. Aucune étude n’existe sur cette approche.
2. Nettoyage
Le nettoyage constitue une étape clé dans la prise en charge des otites et il est parfois négligé. La prolifération auriculaire de Malassezia est, le plus souvent, associée à la production d’un cérumen important. L’utilisation d’un nettoyant auriculaire présentant des propriétés céruminolytiques est donc à privilégier.
Peu d’études concernant l’activité antifongique in vitro des différents nettoyants auriculaires ont été publiées (Swinney 2008, Mason 2013). Les résultats diffèrent selon les études et sont difficiles à interpréter. Ces études in vitro ne prennent, par ailleurs, pas en compte les autres propriétés du nettoyant, telles que son action céruminolytique ou l’impact d’une réaction inflammatoire sur son activité.
Un délai de 30 minutes entre le nettoyage auriculaire et l’instillation du produit auriculaire traitant est, souvent, recommandé. Cette recommandation reste, toutefois, empirique sans qu’une étude ne se soit spécifiquement intéressé au délai idéal devant séparer ces deux actions.
Aucun consensus n’existe actuellement concernant la fréquence des nettoyages auriculaires. Cela dépend du type d’otite, du produit utilisé et de l’existence de facteurs prédisposants ou aggravants.
3. Traitement topique
- Traitement topique contenant un antifongique
Le traitement topique est la règle lors d’otites à Malassezia. Plusieurs traitements topiques, contenant un dérivé azolé (miconazole, clotrimazole, posaconazole), de la nystatine ou de la terbinafine sont disponibles. Il ne semble pas exister de différences majeures d’activité entre ces différentes molécules.
Malheureusement, la majorité des topiques auriculaires traitants est polyvalente et associe un antibiotique, un antifongique, un corticoïde, voir un antiparasitaire, ce qui limite la possibilité d’un traitement spécifique, notamment l’utilisation d’un antifongique seul.
- Traitement topique « alternatif »
L’utilisation de traitements alternatifs a été publiée sur des cas isolés.
L’effet antifongique de certaines huiles essentielles contre les Malassezia issue d’otites externes canines a récemment été confirmé, in vitro, pour les huiles essentielles d’origan, de thym, de cannelle, ainsi que leur principal composant, le carvacrol, le thymol et le cinnamaldéhyde (Sim 2019a et b). Une action synergique existerait avec les antifongiques ou le Tris-EDTA (Schlemmer 2019, Sim 2019 b).
La majorité des souches de Malassezia sont capables de produire un biofilm limitant l’efficacité des traitements (Figueredo 2012). L’utilisation de produit auriculaire permettant de lutter contre celui-ci, notamment ceux contenant de la N-acétylcystéine, sont donc probablement intéressant lors d’otites à Malassezia.
Les peptides antimicrobiens possèdent une activité antifongique in vitro (Santoro 2014). Leur utilisation intra-auriculaire pourrait donc également présenter un intérêt pour limiter la prolifération des levures.
Enfin, un sous-type particulier de Malassezia pachydermatis (sous type 3 D) serait plus fréquemment isolé chez les chiens atopiques. Ce sous-type croit plus facilement en milieu alcalin que les autres, ce qui soulève la question de l’intérêt des topiques acidifiants (Matousek 2003, Kobayashi 2011).
4. Traitement systémique
Le recours à un traitement antifongique systémique lors d’otite à Malassezia est sujet à controverse. Le traitement systémique ne diffuserait pas assez dans les conduits auditifs pour certains auteurs. Une seule étude s’est intéressée à l’effet antifongique de l’itraconazole par voie systémique sur le nombre de Malassezia auriculaires et n’a pas montré de différence quant au nombre de levures (Pinchbeck 2002).
Un traitement systémique peut, toutefois, être envisagé dans les cas sévères, lors de difficulté à instiller des produits topiques, lors de sténose marquée ou d’atteinte concomitante des pavillons auriculaires. Dans ce cas, une extrapolation des données existant pour le traitement des dermatites à Malassezia est possible. Le kétoconazole à la dose de 5-10 mg/kg/j en 1 prise par jour 21 jours ou l’itraconazole à la dose de 5 mg/kg/j 21 jours ou 2 jours consécutifs par semaine peuvent être utilisés avec un bon niveau de preuve d’efficacité (Negre 2008). L’absorption du kétoconazole est meilleure lorsque la prise est associée à un repas, cela ne semble pas être le cas pour l’itraconazole.
Aucune différence d’efficacité n’a été démontrée pour le kétoconazole utilisé à 5 mg/kg/j ou 10 mg/kg/j (Bensignor 2001).
Notons que les azolés systémiques- kétoconazole et itraconazole – ne présentent pas d’AMM pour le traitement des dermatites à Malassezia chez le chien en France.
En 2010, l’équipe de Nijima a rapporté, pour la première fois, l’existence d’une souche de Malassezia pachydermatis issue d’un chien présentant une dermatose séborrhéique résistante à l’itraconazole ou au kétoconazole. Par ailleurs, les souches issues d’animaux régulièrement traités seraient moins sensibles aux azolés que celles issues d’animaux non traités (Cafarchia 2012).
La mise en évidence d’une résistance aux antifongiques est difficile en pratique courante car il n’y a pas de consensus dans le protocole à utiliser et le choix des valeurs critiques pour les antifongiques topiques ou systémiques. Même si l’immense majorité des souches de Malassezia pachydermatissont actuellement sensibles aux azolés, ces données doivent probablement amener à relativiser le recours systématique aux topiques azolés en entretien ou aux antifongiques systémiques de façon répétée.
CONCLUSION
La mise en évidence de Malassezia dans une oreille de chien doit toujours conduire à rechercher et traiter spécifiquement une cause primaire sous-jacente, en particulier une dermatose par hypersenbilité. L’examen cytologique du cérumen obtenu par écouvillonnage demeure la règle pour la mise en évidence des levures intra-auriculaires. Le traitement repose, essentiellement, sur un nettoyage et l’utilisation d’un topique auriculaire antifongique.
La meilleure appréhension des facteurs de virulence et de pathogénicité des levures (développement suite à un contexte inflammatoire, production de biofilm par exemple) et la description de résistance aux antifongiques amèneront certainement à faire évoluer cette approche thérapeutique.
RÉFÉRENCES BIBLIOGRAPHIQUES
- Bensignor E. Oral itraconazole as a pulse therapy for the treatment of canine Malassezia dermatitis : a randomized, blinded, comparative trial. Prat Med Chir Animal Comp. 2006 ; 41 : 69-72.
- Bensignor E. Comparaison de deux posologies de kétoconazole pour le traitement de la dermatite à Malassezia chez le chien. Ann Méd Vét. 2001 ; 145 : 311-6.
- Cafarchia C, Figueredo LA, Latta R et al. In vitro antinfungal susceptibility of Malassezia pachydermatis from dogs with and without skin lesions. Vet Microbiol. 2012 ; 155 : 395-8.
- Choi N, Edginton HD, Griffin CE et al. Comparison of two ear cytological collection techniques in dogswith otitis Vet Dermatol. 2018 ; 29 : 413-e136.
- Figueredo LA, Cafarchia C, Desantis S et al. Biofilm formation of Malassezia pachydermatis from dogs. Vet Microbiol. 2012 ; 160 : 126-31.
- Ginel PJ, Lucena R, Rodriguez JC et al. A semiquantitative cytological evaluation of normal and pathological samples from the external ear canals of dogs and cats. Vet Dermatol 2002 ; 13 : 151-6.
- Kobayashi T, Kano R, Nagata M et al. Genotyping of Malassezia pachydermatis isolates from canine healthy skin and atopic dermatitis by internal spacer 1 (IGS1) region analysis. Vet Dermatol 2011; 22: 401-5.
- Mason CL, Steen SI, Paterson S et al. Study to assess in vitro antimicrobial activity of nine ear cleaners against 50 Malasseziapachydermatis Vet Dermatol. 2013 ; 24 : 362-6.
- Matousek JL, Campbell KL, Kakoma I et al. Evaluation of the effect of pH on in vitro growth of Malassezia pachydermatis. Can J Vet Res 2003; 67: 56-9.
- Nardoni S, Dini M, Taccini F et al. Occurrence, distribution and population size of Malassezia pachydermatis on skin and mucosae of atopic dogs. Vet Microbiol. 2007 ; 122 : 172-7.
- Negre A, Bensignor E, Guillot J. Evidence-based veterinary dermatology: a systematic review of interventions for Malassezia dermatitis in dogs. Vet Dermatol. 2008 ; 20 : 1-12.
- Pinchbeck LR, Hillier A, Kowalski JJ et al. Comparison of pulse administration versus once daily administration of itraconazole for the treatment of Malassezia pachydermatis dermatitis and otitis in dogs. J Am Vet Med Assoc. 2002 ; 220 : 1807-12.
- Puig L, Castella G and Cabanes FJ. Quantification of Malassezia pachydermatis by real-time PCR in swabs from the external ear canal of dogs. J Vet Diag Invest. 2019 ; 31 : 440-7.
- Santoro D and Maddox CW. Canine antimicrobial peptides are effective against resistant bacteria and yeasts. Vet Dermatol. 2014 ; 25 : 35-e12.
- Schlemmer KB, Jesus FPK, Tondolo JSM et al. In vitro activity of carvacrol, cinnamaldehyde and thymol combined with antifungals against Malassezia pachydermatis. J Mycol Med. 2019 ; 29 : 375-7.
- Sim JXF, Khazandi M, Chan WY et al. Antimicrobial activity of thyme oil, oregano oil, thymol and carvacrol against sensitive and resistant microbial isolates from dogs with otitis externa. Vet Dermatol. 2019 ; 30 : 524-e159.
- Sim JXF, Khazandi M, Pi H et al. Antimicrobial effects of cinnamon essential oil and cinnamaldehyde combined with EDTA against canine otitisexterna pathogens. J Appl Microbiol. 2019 ; 127 : 99-108.
- Swinney A, Fazakerley J, McEwan N et al. Comparative in vitro antimicrobial efficacy of commercial ear cleaners.Vet Dermatol. 2008 ; 19 : 373-9.
- Toma S, Cornegliani L, Persico P et al. Comparison of 4 fixation and staining methods for the cytologic evaluation of ear canals with clinical evidence of ceruminous otitis externa. Vet Clin Pathol. 2006 ; 35 : 194-8.
- Zur G, Lifshitz B and Bdolah-Abram T. The association between the signalment, common causes of canine otitisexterna and pathogens. J Small Anim Prat. 2011 ; 52 : 254-8.
