Chylothorax d’origine idiopathique chez un chat – intérêt de la lymphangiographie scanner
Dr Thomas CORNET (ONIRIS) – Dr Lucile GROS (ENVT) – Dr Rachel BUTTIN – Dr Anne-Charlotte BARROT (CHV Saint-Martin)
Anamnèse
Une chatte Maine Coon stérilisée de 6 ans est référée pour prise en charge d’un épanchement pleural. Elle présente une dyspnée d’apparition aigüe depuis 2 jours, un abattement et une dysorexie.
Aucun antécédent de traumatisme n’est rapporté. Le chat n’a pas voyagé récemment.
Examen clinique
A l’examen clinique d’admission, le patient est abattu et présente une dyspnée à dominante inspiratoire ainsi qu’une tachypnée. L’auscultation révèle des bruits cardiaques et respiratoires atténués. Le reste de l’examen clinique est dans les normes.
Examens complémentaires
Des radiographies thoraciques sont réalisées après stabilisation de l’animal (oxygénothérapie, butorphanol 0.2 mg/kg IM). Elles révèlent un épanchement pleural bilatéral plus marqué à droite (Image 1). L’évaluation du médiastin et de l’ensemble du champ pulmonaire est rendue difficile par la présence de l’épanchement pleural marqué.
Une thoracocentèse est réalisée: deux cent millilitres d’un liquide laiteux sont ponctionnés à droite et 35 ml à gauche (Image 2).
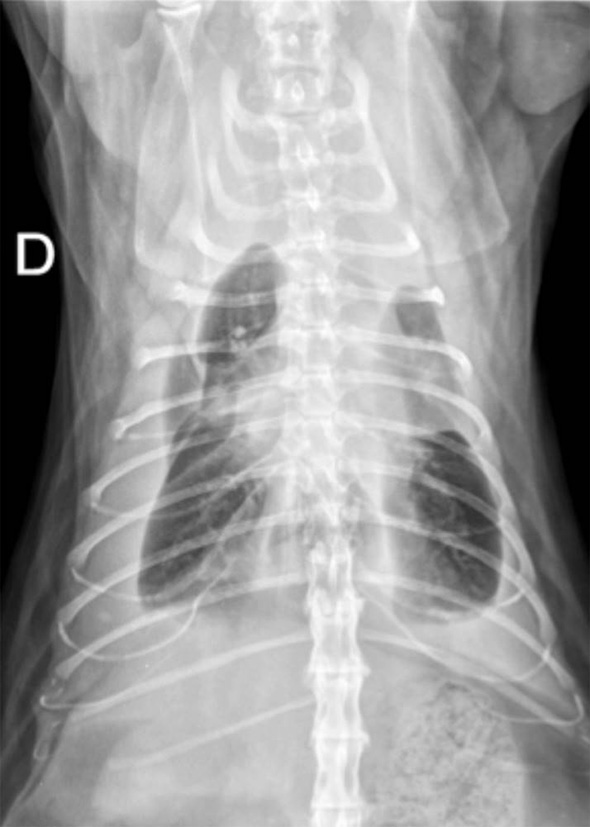
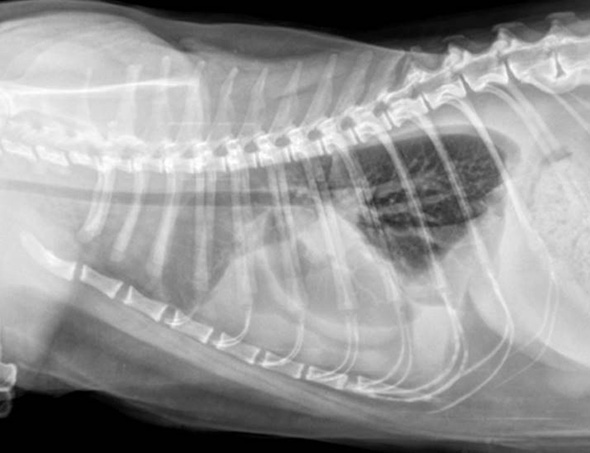 Image 1: Radiographies dorsiventrale et latérale droite du thorax révélant un épanchement pleural sévère.
Image 1: Radiographies dorsiventrale et latérale droite du thorax révélant un épanchement pleural sévère.
 Image 2: Liquide pleural ponctionné d’aspect laiteux
Image 2: Liquide pleural ponctionné d’aspect laiteux
Les triglycérides sont dosés dans l’épanchement et le sang: leur valeur est supérieur à 3.75 g/L dans l’épanchement, ce qui est nettement plus élevée que la triglycéridémie (0.66 g/L, VU : 0.10-1.00). La densité du liquide d’épanchement est de 1.048 et les protéines totales à 55 g/L. La cytologie de l’épanchement montre des lymphocytes et la présence de quelques neutrophiles.
Il s’agit donc d’un chylothorax.
Une échocardiographie est réalisée et révèle une cardiomyopathie hypertrophique concentrique asymétrique débutante sans dilatation cavitaire associée dont la faible sévérité ne permet pas d’expliquer la présence d’un chylothorax.
Une lymphangiographie associée à un scanner est effectuée. Cinq ml de produit de contraste sont injectés dans un nœud lymphatique mésentérique de manière échoguidée. L’examen scanner ne met en évidence aucune rupture du canal thoracique (Image 3).
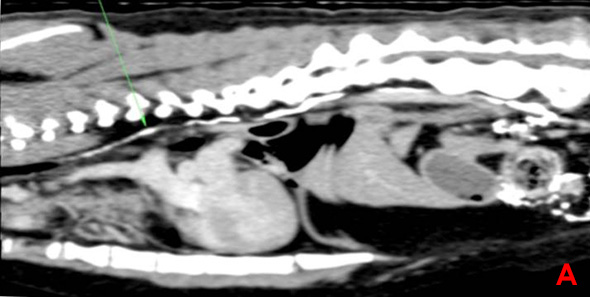
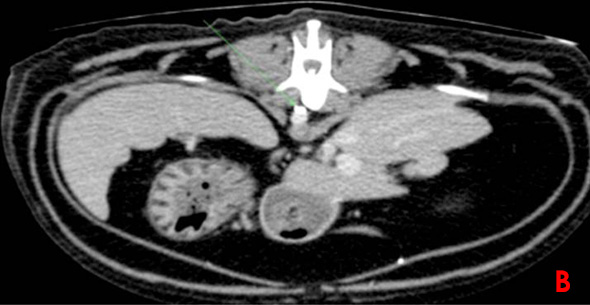
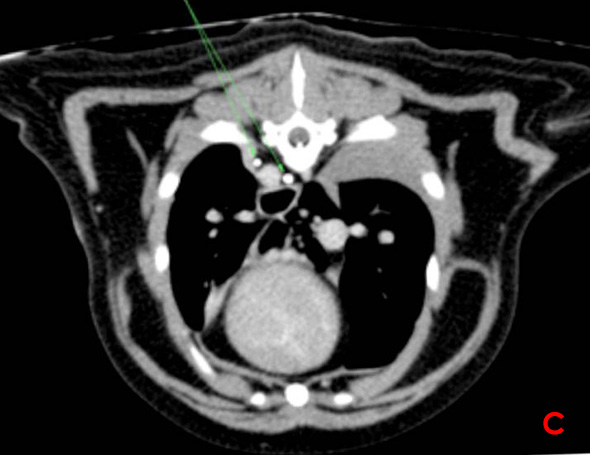 Image 3: Lymphangiographie par scanner avec reconstruction parasagitale (A), coupe transverse au niveau de la vertèbre L1 (B) et de la vertèbre T9 (C). Le canal thoracique est identifié par les flèches vertes. Il présente des ramifications en portion craniale et aucune fuite de produit de contraste n’est constatée.
Image 3: Lymphangiographie par scanner avec reconstruction parasagitale (A), coupe transverse au niveau de la vertèbre L1 (B) et de la vertèbre T9 (C). Le canal thoracique est identifié par les flèches vertes. Il présente des ramifications en portion craniale et aucune fuite de produit de contraste n’est constatée.
Sur la base des examens réalisés, un diagnostic de chylothorax d’origine idiopathique est établi.
Traitement
Une prise en charge chirurgicale est réalisée après stabilisation médicale de l’animal. Avant la chirurgie, dix millilitres de crème fraîche sont administrés afin de faciliter la visualisation du canal thoracique.
1. Ligature du canal thoracique
La ligature du canal thoracique est réalisée dans sa portion thoracique, par un abord latéral gauche, par thoracotomie au niveau du 9ème espace intercostal. Il est visualisé ventralement aux vertèbres thoraciques, isolé par rapport à l’aorte et des tissus conjonctifs l’entourant, en regard de la 8ème vertèbre thoracique, puis ligaturé. Après la pose de la ligature, une dilatation du canal caudalement à la ligature est constatée sans fuite de liquide lymphatique.
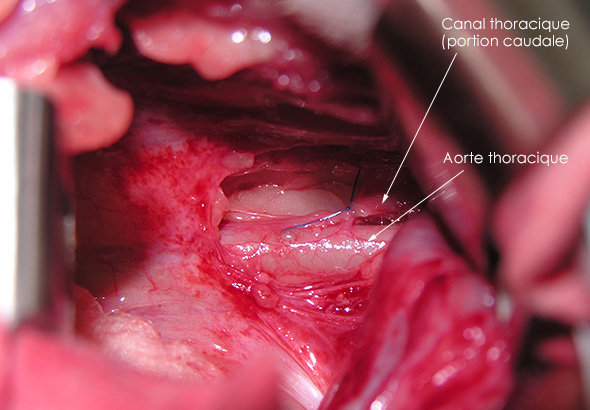 Image 4 : Ligature du canal thoracique.
Image 4 : Ligature du canal thoracique.
2. Péricardectomie subtotale
La péricardectomie est réalisée par une seconde thoracotomie au niveau du 6ème espace intercostal. Le péricarde très épaissi est ouvert ventralement aux nerfs phréniques (Image 5), et découpé sur toute sa circonférence (Image 6).
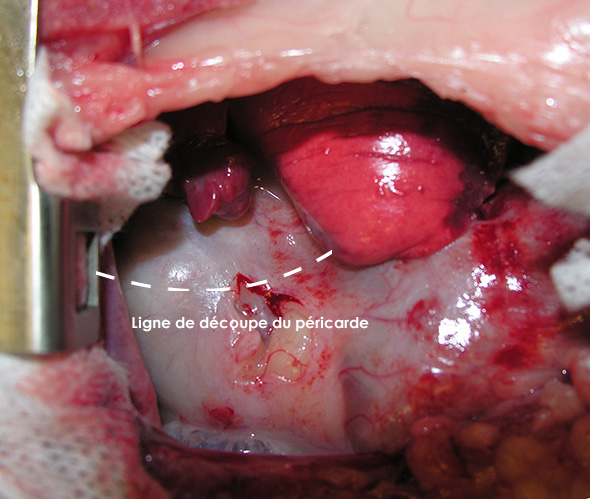 Image 5 : Incision dans le péricarde particulièrement épais.
Image 5 : Incision dans le péricarde particulièrement épais.
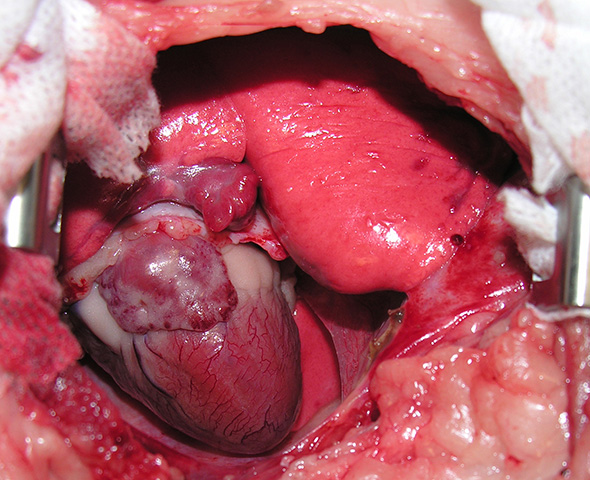 Image 6 : Péricardectomie subtotale.
Image 6 : Péricardectomie subtotale.
3. Omentalisation de la cavité thoracique
Par le biais de l’abord intercostal précédemment réalisé, le diaphragme est ouvert le long de ses insertions costales à gauche, sur une distance de 5 cm, donnant directement accès à l’abdomen crânial. Une portion d’omentum est introduite dans la cavité thoracique et pexiée à la paroi ventro-latérale gauche. Le diaphragme est refermé autour de celui-ci et un drain thoracique est mis en place.
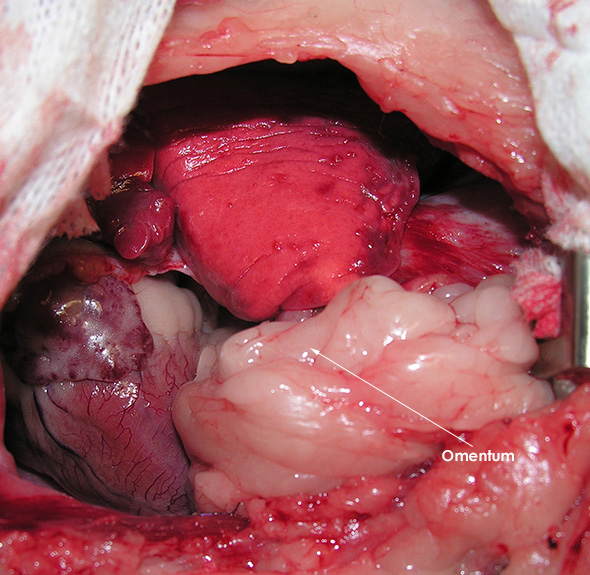 Image 7 : Omentalisation de la cavité thoracique.
Image 7 : Omentalisation de la cavité thoracique.
4. Soins postopératoires
Après le drainage régulier de la cavité thoracique, le drain est retiré lorsque la quantité de liquide retirée était inférieure à 2 ml/kg/j quatre jours après l’intervention. Une antibiothérapie (amoxicilline-acide clavulanique 12,5 mg/kg BID) et une analgésie (morphine 0,1 à 0,3 mg/kg/4h) sont également instaurées. De la rutine (50 mg/kg TID) est également administrée. Aucune complication périopératoire n’est intervenue.
Suivi
Lors du suivi téléphoniques deux mois après la chirurgie, le patient une très bonne qualité de vie sans aucun signe respiratoire. Sept mois après l’intervention, la chatte a présenté un nouvel épisode de dyspnée. Les propriétaires ont souhaité euthanasier l’animal sans que le vétérinaire traitant n’ait pu faire de tests diagnostiques pour déterminer l’origine des symptômes respiratoires.
DISCUSSION
Le chylothorax est une affection rare chez le chat, d’étiologie variée. La recherche de sa cause est essentielle et demande la réalisation d’examens complémentaires.
Le chyle est un fluide constitué de lymphe et d’une grande quantité de graisses provenant de l’intestin et drainée à partir des vaisseaux mésentériques, se déversant dans la veine cave crâniale. Le chylothorax est une accumulation de chyle dans l’espace pleural (4).
• Etiologie
Le chylothorax est essentiellement dû à une dilatation des vaisseaux lymphatiques avec extravasation du chyle. Les ruptures traumatiques du canal thoracique sont peu fréquentes (1, 4).
La lymphangiectasie peut être due à une augmentation de la production de lymphe par le foie, ou à un défaut de drainage lymphatique dans le système veineux. Les cardiopathies (cardiomyopathies, dirofilariose…), les tumeurs lymphatiques ou médiastinales, les granulomes fongiques, une thrombose de la veine cave, une hernie péritonéo-péricardique ou diaphragmatique, une torsion de lobe pulmonaire ou des anomalies congénitales du canal thoracique peuvent être à l’origine d’un défaut de drainage lymphatique (1, 4).
Des radiographies thoraciques, une échocardiographie ou la recherche de dirofilariose lorsque cela est justifié sont, par conséquent, les examens complémentaires de choix pour rechercher la cause du chylothorax. Une lymphangiographie peut également être réalisée dans le but de détecter une rupture du canal thoracique. Etant donné les variations anatomiques importantes du canal thoracique entre les individus, l’examen scanner permet d’optimiser l’identification du canal thoracique et son réseau collatéral en vue de planifier l’abord chirurgical et la localisation de la ligature. Si aucune anomalie n’est mise en évidence lors de ces examens, le chylothorax est dit idiopathique (1, 4).
Le traitement du chylothorax consiste à traiter la cause sous-jacente si elle est connue.
Un traitement médical doit être tenté initialement. Des thoracocentèses répétées permettent de soulager l’animal dyspnéique mais si elles deviennent trop fréquentes, elles peuvent favoriser des déperditions caloriques, volumiques et cellulaires (1, 4). Il est conseillé d’instaurer une alimentation pauvre en graisses de manière à réduire la quantité d’acides gras dans l’épanchement (cela favorise la réabsorption de l’épanchement par les plèvres) (1, 4). La rutine peut également être utilisée (50 à 100 mg/kg TID) pour stimuler l’activité macrophagique et favoriser la réabsorption de fluides mais son efficacité réelle n’a pas été démontrée (1, 5). L’utilisation d’octréotide chez l’homme diminuerait le volume de chyle produit et serait intéressant après la ligature du canal thoracique pour favoriser sa cicatrisation (1).
Si le traitement médical est inefficace ou si le chylothorax est idiopathique, un traitement chirurgical doit être entrepris. Il repose sur la ligature de la partie caudale du canal thoracique. Si elle est réalisée seule, le chylothorax se résout dans 21 à 53 % des cas chez le chat (3,8). Lorsque la péricardectomie y est associée, une étude montre un taux de résolution du chylothorax de 80% (6,7). Les animaux avec un chylothorax peuvent en effet présenter un péricarde épaissi à cause de l’irritation chronique du chyle. Cet épaississement constitue une résistance à l’écoulement sanguin et augmente les pressions veineuses à l’origine d’un mauvais drainage du canal thoracique. Pour cette raison, la péricardectomie est indiquée lors de chylothorax (1,8).
Une omentalisation de la cavité pleurale peut être associée aux techniques précédentes pour faciliter le drainage mais des études sont nécessaires pour prouver son réel intérêt.
La présence d’une pleurésie restrictive péjore le pronostic. Une prise en charge chirurgicale précoce limiterait le risque d’apparition de cette pleurésie et améliorerait donc le pronostic (4).
RÉFÉRENCES BIBLIOGRAPHIQUES
- Ludwig L, et al. Pleural and extrapleural diseases. In : Ettinger S, Feldman E, Textbook of veterinary internal medicine, 7th edition, Philadelphia: Saunders Co, 2010; 232: 1131-35.
- Fossum T. W et al., Small Animal Surgery, 3rd edition, Philadelphia: Elsevier, 2013; 31: 1017-25.
- Birchard SJ, Smeak DD, McLoughlin MA : Treatment of idiopathic chylothorax in dogs and cats. J Am Vet Med Assoc. 1998; 212: 652.
- Hernandez J, Poncet C, Chylothorax. In : Maladies respiratoires du chien et du chat. Editions du Point Vétérinaire; 2012 ; 328-334.
- Thompson MS, Cohn LA, Jordan RC. Use of rutin for medical management of idiopathic chylothorax in four cats. J Am Vet Med Assoc. 1999; 215: 345.
- Mates-Lorenzo L, Bernard F, Intérêt de la lymphangiographie par scanner lors de chylothorax chez le chat. La semaine vétérinaire. Septembre 2014; 46-47.
- Fossum TW, Mertens MM, Miller MW, et al. Thoracic duct ligation and pericardectomy for treatment of idiopathic chylothorax. J Vet Intern Med; 18: 307 2004
- Fossum TW, Chylothorax in cats: is there a role for surgery? Journal of Feline Medicine and Surgery. 2001; 3: 73-79.
