Un cas d’anisocorie chez une chatte
Dr Thomas DULAURENT (CHV Saint-Martin), Dr Olivier FONTAINE, Dr Pierre-François ISARD (CHV Saint-Martin)
Nalla, chatte européenne de 13 ans, a été présentée en consultation pour une anomalie de diamètre pupillaire apparue quelques jours plus tôt. Dans l’historique médical, il a été noté qu’elle avait été opérée d’un fibrosarcome dans la région lombaire quelques mois plus tôt. L’analyse anatomo-pathologique avait alors révélé des marges d’exérèse saines. Quelques jours avant la visite, Nalla avait été opérée d’une petite masse dans la région de la truffe. La propriétaire a rapporté une respiration un peu rapide depuis quelques jours.

Mydriase anisocorique gauche : la pupille gauche ne se contracte pas à la lumière
Examen clinique
L’examen clinique général a permis de confirmer une tachypnée modérée. Nalla était normotherme pendant l’examen et ne présentait pas d’autre anomalie des grandes fonctions. A l’examen oculaire, Nalla présentait une réponse positive à la menace et à l’éblouissement. Les réflexes photomoteurs étaient absents des deux côtés. La pupille de l’œil droit était en myosis et ne se dilatait pas du tout à l’obscurité, tandis que la pupille de l’œil gauche était en mydriase et ne se contractait pas sous lumière vive (photos 1 et 2). L’examen ophtlamoscopique n’a révélé aucune anomalie. La pression intra-oculaire a été mesurée à 17 mm Hg pour chaque œil par tonométrie à rebond.

Myosis anisocorique droit : la pupille droite ne se dilate pas à l’obscurité
Diagnostic clinique
Le diagnostic clinique était donc une ophtalmoplégie interne (paralysie des muscles intraoculaires). Plus précisément, Nalla présentait une mydriase anisocorique gauche et un myosis anisocorique droit. Elle présentait donc une paralysie motrice du muscle dilatateur de la pupille droite et du muscle constricteur de la pupille gauche. La dilatation pupillaire étant sous le contrôle du système nerveux sympathique et la contraction pupillaire sous le contrôle du système nerveux parasympathique, il fallait rechercher les causes d’une atteinte conjointe de ces deux systèmes.
Examens complémentaires
La distribution du système nerveux autonome étant cérébrale et thoracique, un scanner de l’encéphale et une radiographie thoracique ont été proposés. Pour des raisons financières, seule la radiographie a été réalisée. Elle a permis de mettre en évidence de nombreuses métastases dans le champ pulmonaire (photo 3). La présence de ces métastases expliquait le myosis anisocorique droit par compression du tronc sympathique (syndrome de Claude Bernard-Horner à manifestations partielles). La cause de l’atteinte du système nerveux parasympathique restait inconnue (système nerveux à distribution uniquement encéphalique).
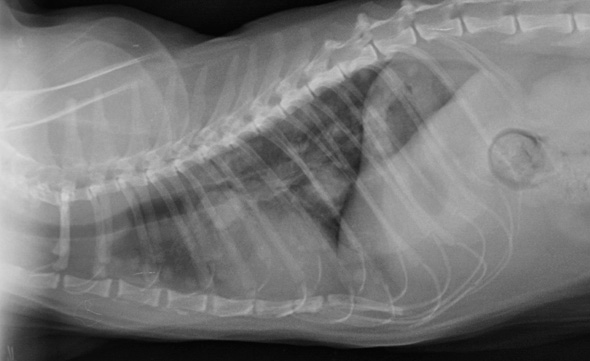
Radiographie pulmonaire. Noter la présence de très nombreuses métastases dans le champ pulmonaire.
Diagnostic étiologique
L’examen clinique, combiné aux résultats de la radiographie thoracique, ont permis d’établir le diagnostic de métastases pulmonaires, très probablement liées au fibrosarcome opéré quelques mois auparavant, malgré les marges saines identifiées à l’analyse anatomo-pathologique suite à son exérèse. La présence de métastases explique aussi les signes respiratoires manifestés par Nalla quelques jours avant la visite.
Traitement
Un traitement palliatif à base d’anti-inflammatoires stéroïdiens à dose anti-inflammatoire a été instauré par voie orale. Aucun traitement oculaire n’a été proposé le jour de la visite.
Suivi
Quelques jours après la consultation, une procidence de la membrane nictitante est apparue du côté droit, complétant le tableau du syndrome de Claude Bernard-Horner à droite. Un traitement symptomatique local à base de néosynéphrine 10% a été mis en place à raison d’une instillation trois fois par jour pendant 1 mois. Quelques jours après, la chatte a été euthanasiée en raison de manifestations respiratoires trop invalidantes.
DISCUSSION
Le fibrosarcome est un phénomène tumoral fréquent chez le chat (17.4% des tumeurs cutanées [1]). La majorité des fibrosarcomes naissent de la peau, du tissu conjonctif sous-cutané ou de la cavité buccale [2]. De nombreux facteurs favorisants ont été évoqués dans la littérature (fibrosarcomes viro-induits, réactions aux injections vaccinales [3, 4, 5], persistances de corps étrangers dans le derme ou le tissu sous-cutané [6, 7, 8], inflammation chronique…) même si de nombreux cas de fibrosarcomes spontanés existent. Le site de métastases le plus fréquent est représenté par les poumons [9], même si l’œil [10, 11] et le cerveau [12] peuvent aussi être affectés. Le traitement des fibrosarcomes fait principalement appel à la chirurgie (exérèse large) [13], associée à de la radiothérapie interstitielle (Curiethérapie à l’aide de fils d’iridium 192). Une chimiothérapie systémique (doxorubicine, vincristine, vinblastine ou lomustine [14]) ou encore de l’immunothérapie [15] peuvent également être utilisées. Le taux de récidives, malgré la mise en place de traitements agressifs, est malheureusement important. Dans notre cas, la présence de métastases pulmonaires et probablement cérébrales rendait l’opportunité d’une radiothérapie ou d’un traitement adjuvant illusoire.
L’intérêt de ce cas réside dans une présentation clinique peu commune. En effet, l’atteinte conjointe des systèmes nerveux autonomes sympathique (syndrome de Claude Bernard-Horner) et parasympathique est rare, la distribution de ces systèmes étant différente (figures 1 et 2). Dans notre cas, la cause de l’atteinte du système nerveux sympathique a pu être mise en évidence. Il s’agissait de la compression du tronc sympathique au sein de la cage thoracique par le phénomène tumoral. L’atteinte du système nerveux parasympathique n’a quant à elle pas pu être précisée. De par la distribution strictement encéphalique de ce système, la réalisation d’un scanner de la tête aurait peut-être permis la visualisation de métastases cérébrales. Les caractéristiques épidémiologiques et cliniques de l’affection dont souffrait Nalla devaient faire penser à un phénomène compressif. Il s’agit d’un bon exemple de maladie systémique dont les manifestations peuvent être oculaires.
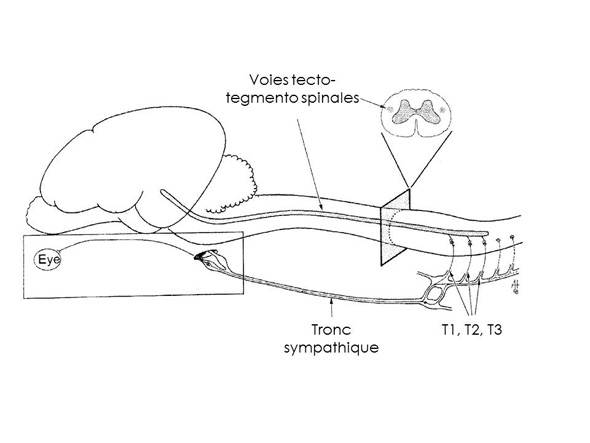
Innervation sympathique de l’œil
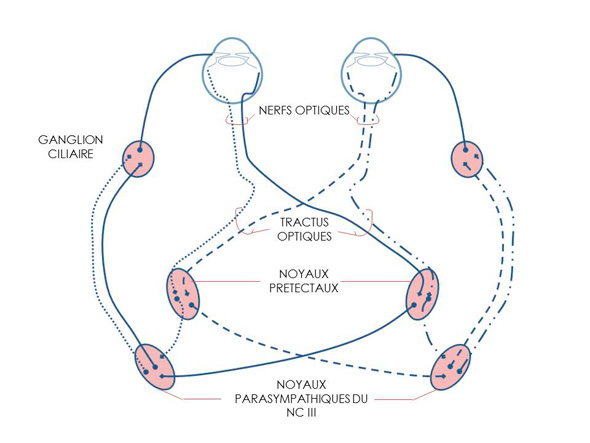
Innervations parasympathique de l’œil
RÉFÉRENCES BIBLIOGRAPHIQUES
- Bostock DE. Neoplasms of the skin and subcutaneous tissues in dogs and cats, Br Vet J 1986 ; 142 : 1-19.
- Henry CJ. The Biology and Pathogenesis of Cancer, In : Withrow & MacEwen’s Small Animal Clinical Oncology Fourth Edition, Ed Saunders Elsevier St Louis, Missouri 2007.
- De Man MM, Ducatelle RV. Bilateral subcutaneous fibrosarcomas in a cat following feline parvo-, herpes- and calicivirus vaccination. J Feline Med Surg 2007; 9: 432-434.
- Gumber S, Wakamatsu N. Vaccine-associated fibrosarcoma with keloidal differentiation in a cat. J Vet Diagn Invest 2011 ; 23 : 1061-1064.
- Deim Z et al. Feline vaccine-associated fibrosarcoma induced by aluminium compound in two cats : short communication. Acta Vet Hung 2008; 56 : 111-116.
- Daly MK et al. Fibrosarcoma adjacent to the site of microchip implantation in a cat. J Feline Med Surg 2008; 10: 202-205.
- Carminato A et al. Microchip-associated fibrosarcoma in a cat. Vet Dermatol 2011 ; 22: 565-569.
- Haddad JL et al. Fibrosarcoma arising at the site of a retained surgical sponge in a cat. Vet Clin Pathol 2010 ; 39 : 241-246.
- De Fornel-Thibaud P. Fibrosarcome et bilan d’extension, 15th FECAVA eurocongress AFVAC-SAVAB-LAK Friday 27th, Saturday 28th, Sunday 29th November 2009, Lille, France.
- Cohen M et al. Ocular metastasis of a vaccine-associated fibrosarcoma in a cat. Vet Comp Oncol 2003; 1: 232-240.
- Mowat Fm et al. Bilateral uveal metastasis of a subcutaneous fibrosarcoma in a cat. Vet Ophthalmol 2012 Feb 23 online.
- Snyder SP et al. Morphological studies on transmissible Feline Fibrosarcoma. Cancer Research 1970; 30: 1658-1667.
- Davis KM et al. Feline fibrosarcoma : perioperative management. Compend Contin Educ Vet 2007 ; 29 : 712-714.
- Macy DW. Unpublished data, 1992.
- Hampel V et al. Adjuvant immunotherapy of feline fibrosarcoma with recombinant feline interferon omega. J Vet Intern Med 2007; 21: 1340-1346.
