Mélanome épibulbaire chez une chienne braque allemand de 4 ans
Dr V. Martin (Clinique Vétérinaire Grand Littoral et CHV Massilia, Marseille), Dr Pierre-François ISARD (CHV Saint-Martin), Dr Thomas DULAURENT (CHV Saint-Martin)
Introduction
Les mélanomes épibulbaires, appelés également mélanomes limbiques, sont des tumeurs se développant à partir des mélanocytes du limbe cornéoscléral. Cliniquement, ils se présentent comme des masses pigmentées, bien définies, à bords lisses, se développant au niveau du limbe avec une extension aux tissus adjacents : conjonctivaux, cornéens et scléraux (2). Ils peuvent être occasionnellement non pigmentés (7). Ces tumeurs sont décrites principalement chez le chien, mais il existe aussi de rares cas chez le chat (5,11) et chez le cheval (9).
Ces tumeurs ont une localisation préférentielle au niveau de l’arc dorsal du limbe, du quadrant dorsomédial au limbe ventrolatéral dans plus de 80% des cas (2,4,6). Il n’existe pas de prédisposition selon le côté de l’œil, ni selon le sexe ou la couleur de la robe (2). Par contre, il existe une prédisposition raciale. En effet, les bergers allemands sont surreprésentés dans de nombreuses études (1,6). Et l’étude de Donaldson et al.2006, montre une prédisposition avec un lien héréditaire chez les Goldens et les Labradors retrievers. L’étude des pédigrées de ces deux races suggère que les mélanomes épibulaires, les mélanomes de l’uvée antérieure et les mélanoses oculaires sont héréditaires, et que la même mutation génétique est en cause chez les deux races et pour toutes les maladies mélanocytaires des structures oculaires (2).
L’âge d’apparition des mélanomes épibulbaires a une distribution bimodale, avec un pic d’apparition entre 3 et 4 ans et un vers 7 à 10 ans (2,7). Mais contrairement aux études précédentes, l’étude de Donaldson et al.2006 sur 30 chiens ne montre pas de corrélation entre l’âge d’apparition et l’agressivité de la tumeur (2).
Ce cas clinique décrit l’exérèse d’un mélanome épibulbaire par sclérokératectomie non perforante, suivie d’une réparation de la perte de substance cornéoscléral par une greffe de biomatériau (Tutopatch®), recouverte d’une greffe conjonctivale pédiculée.
Cas Clinique
Anamnèse
Une chienne, braque allemand, stérilisée de 4 ans, a été référée en consultation spécialisée d’ophtalmologie au Centre Hospitalier Vétérinaire de Saint Martin de Bellevue (CHVSM) pour l’évaluation d’un probable mélanome épibulbaire affectant l’œil gauche depuis quelques semaines et envahissant la cornée et la sclère en région dorsale.
Examen d’admission
L’examen de la vision a été considéré comme normal avec une réponse normale aux tests visuels des deux côtés. Les réflexes photomoteurs directs et consensuels étaient présents des deux côtés. L’examen à distance ainsi que l’examen rapproché de l’œil droit n’ont pas révélé d’anomalies. L’examen de l’œil gauche a confirmé la présence d’une masse fortement pigmentée, localisée en région dorsale et envahissant la cornée et la sclère (Cf. Figure 1).
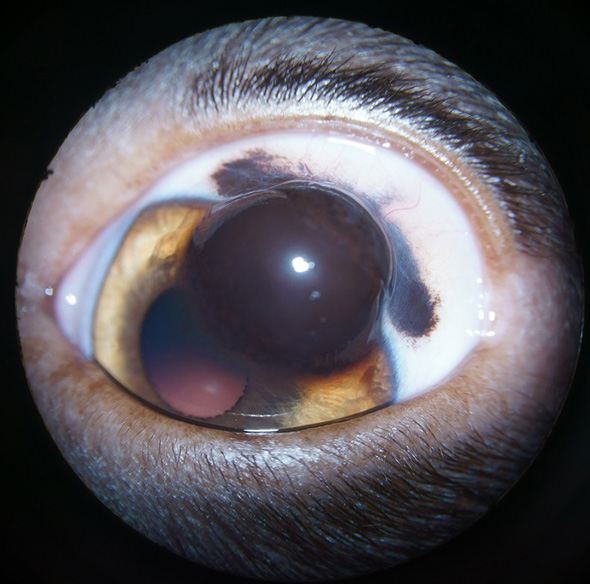 Figure 1 : Aspect de l’œil gauche, lors de la consultation d’admission. Noter l’envahissement de la cornée et de la sclère par la masse pigmentée.
Figure 1 : Aspect de l’œil gauche, lors de la consultation d’admission. Noter l’envahissement de la cornée et de la sclère par la masse pigmentée.
Le reste de l’examen clinique et ophtalmologique n’a pas révélé d’anomalie.
Diagnostic différentiel
Le diagnostic différentiel reposait essentiellement sur la présence d’une masse pigmentée limbique avec comme hypothèse principale un mélanome épibulbaire. Néanmoins, même si la suspicion clinique était très forte, le seul examen ophtalmologique ne permettait pas un diagnostic de certitude. La présence d’un mélanome uvéal à extension transclérale devait être écartée, avant d’envisager l’exérèse de la masse et son analyse histologique.
Examens complémentaires
- Exploration de la masse et de son extension locale :
- Echographie Haute fréquence :
Une échographie haute fréquence a été réalisée afin de définir les contours de la masse (Cf. Figure 2). Celle-ci laissait une portion saine de cornée d’environ 0.36 mm en dessous de la masse. La sclère était envahie en surface mais sa portion profonde était saine.
- Echographie Haute fréquence :
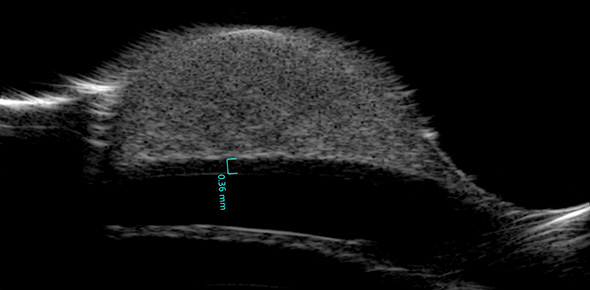 Figure 2 : Image d’échographie UBM à 35 MHz de l’œil gauche. Noter le développement important de la masse et l’épargne du stroma profond de la cornée.
Figure 2 : Image d’échographie UBM à 35 MHz de l’œil gauche. Noter le développement important de la masse et l’épargne du stroma profond de la cornée.
-
- Examen goniosopique :
Un examen gonioscopique a été réalisé et n’a révélé aucun infiltrat intraoculaire ni de l’angle iridocornéen (Cf. Figure 3).
- Examen goniosopique :
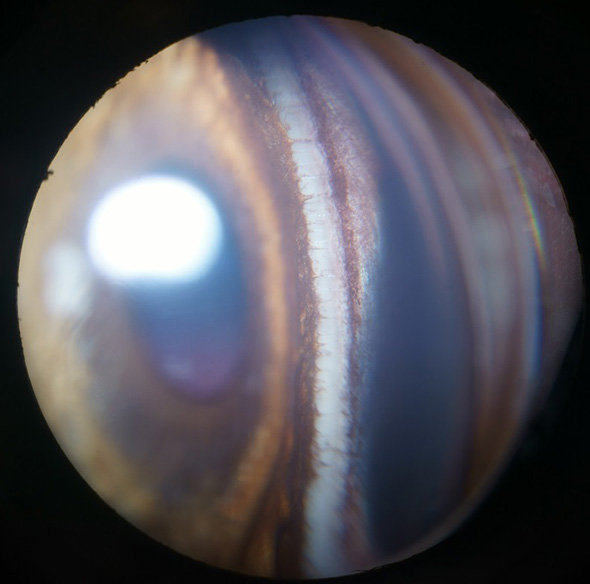 Figure 3 : Aspect normal de l’angle Iridocornéen de l’œil gauche, en regard de la masse limbique.
Figure 3 : Aspect normal de l’angle Iridocornéen de l’œil gauche, en regard de la masse limbique.
- Bilan d’extension à distance :
Bien que l’hypothèse principale ait été un mélanome épibulbaire avec un faible risque de métastase, un scanner de la tête et du thorax a été réalisé comme bilan d’extension, ne révélant aucune anomalie.
Les examens complémentaires pré opératoires ne montrant aucune contrindication à une exérèse chirurgicale, une opération d’ablation la plus complète possible de la masse a donc été décidée.
Technique opératoire
La chienne a été anesthésiée suivant un protocole associant des alpha2-agonistes, de la kétamine et une anesthésie gazeuse à l’isofluorane. Un monitoring cardiorespiratoire a été mis en place tout au long de l’intervention.
La chienne a été placée en décubitus dorsal, le plan irien de l’œil gauche positionné perpendiculairement à l’axe du microscope opératoire. La zone opératoire a ensuite été préparée et désinfectée à l’aide d’une solution de bétadine diluée à 1%.
Un champ opératoire collé, comportant une zone transparente a été mis en place sur l’œil gauche et découpé en suivant l’ouverture palpébrale.
Pour faciliter l’accès à la masse, une canthotomie latérale a été réalisée aux ciseaux de Stevens, puis deux points de fixation ont été placés à trois et neuf heures dans la conjonctive bulbaire (Cf. Figure 4).
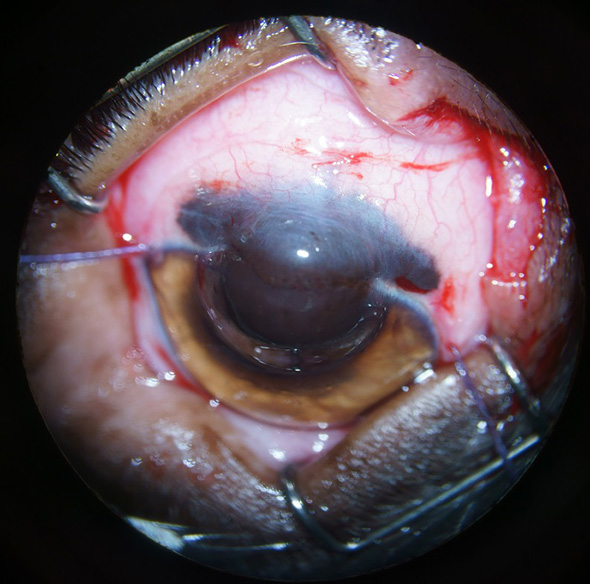 Figure 4 : Image per opératoire, après la réalisation de la canthotomie et la fixation du globe oculaire.
Figure 4 : Image per opératoire, après la réalisation de la canthotomie et la fixation du globe oculaire.
Une incision cornéenne non perforante a été réalisée autour de la masse, à l’aide d’un couteau à cornée (Cf. Figure 5).
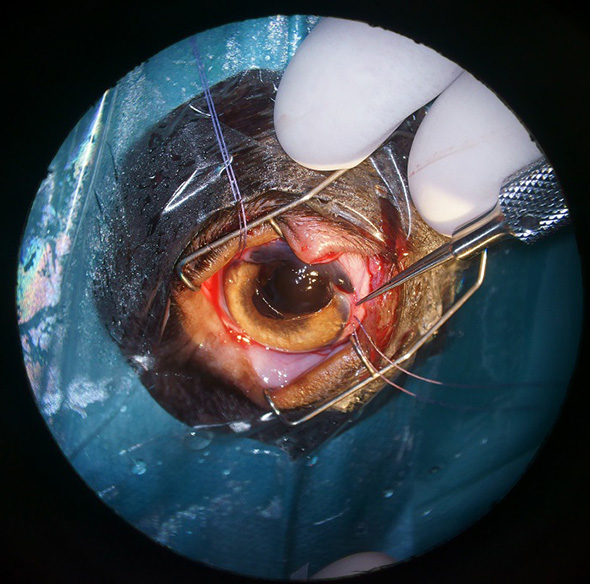 Figure 5 : Aspect per opératoire. Réalisation de l’incision cornéenne.
Figure 5 : Aspect per opératoire. Réalisation de l’incision cornéenne.
Une kératectomie lamellaire passant sous la masse a été effectuée à l’aide d’un couteau cliveur (Cf. Figure 6 et 7) et la partie cornéenne de la masse a été retirée (Cf. Figure 8).
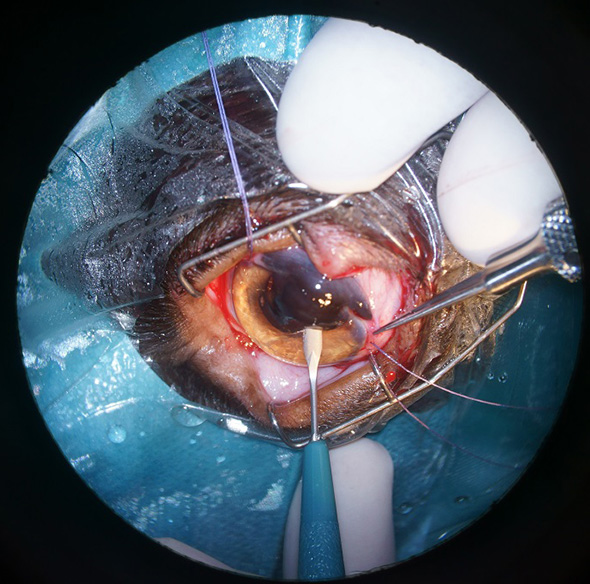 Figure 6 : Image per opératoire. Réalisation de la kératectomie.
Figure 6 : Image per opératoire. Réalisation de la kératectomie.
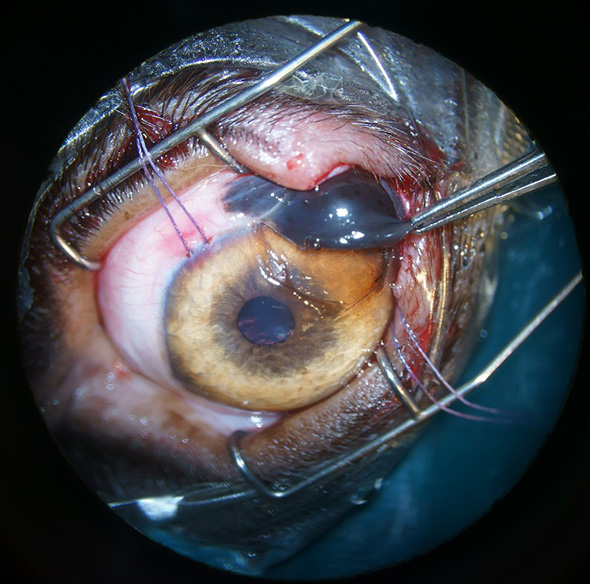 Figure 7 : Image per opératoire, à la fin de la kératectomie.
Figure 7 : Image per opératoire, à la fin de la kératectomie.
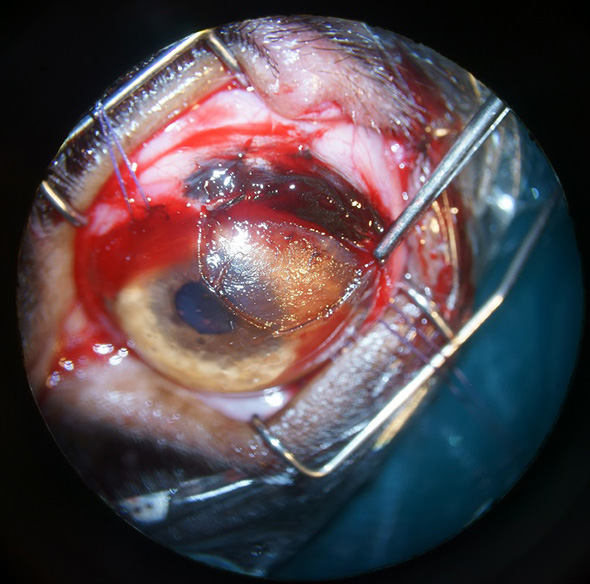 Figure 8 : Image per opératoire. La partie cornéenne de la masse a été excisée.
Figure 8 : Image per opératoire. La partie cornéenne de la masse a été excisée.
La portion sclérale de la masse a ensuite été excisée lors d’une sclérectomie, réalisée en disséquant la sclère en profondeur, au niveau de la lamina fusca, au moyen d’un couteau cliveur et de ciseaux de Castroviejo (Cf. Figure 9). Les marges de la sclérokératectomie ont ensuite été inspectées, de façon à parer les zones susceptibles de contenir des cellules anormales.
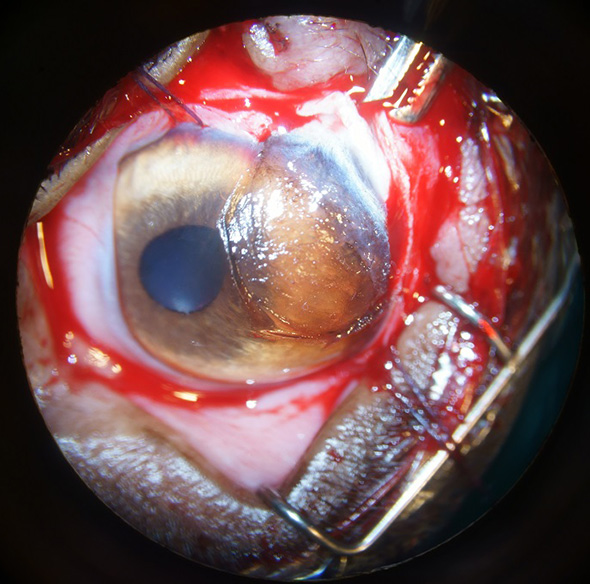 Figure 9 : Image per opératoire. Retrait complet de la masse. Noter la visualisation de la lamina fusca en région sclérale
Figure 9 : Image per opératoire. Retrait complet de la masse. Noter la visualisation de la lamina fusca en région sclérale
La sclérokératectomie ayant été réalisée en profondeur, la greffe d’un biomatériau a été nécessaire de façon à combler la perte de substance et à rapporter de la solidité au globe oculaire. La greffe d’un biomatériau permet d’apporter une trame collagénique, qui est ensuite colonisée lors de la cicatrisation cornéenne. Lors de cette intervention, le biomatériau choisi, était du péricarde de bœuf (Tutopatch®), dont l’épaisseur est plus importante que d’autres biomatériaux existants. Le greffon a été suturé au lit de la sclérokératectomie par des points simples de Vicryl 9.0 (Cf. Figure 10).
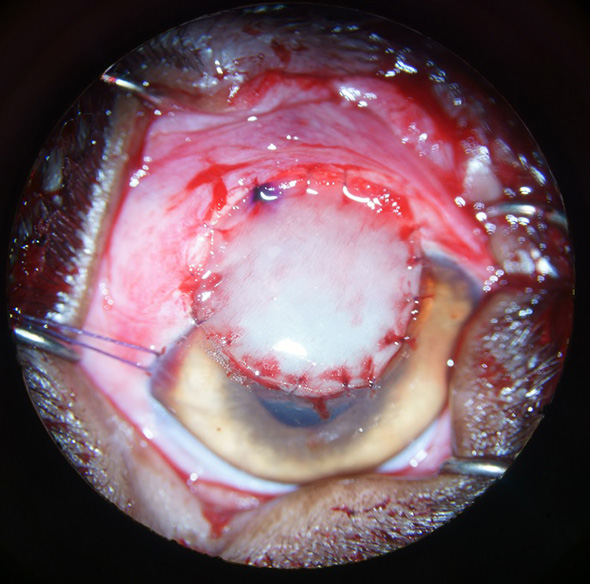 Figure 10 : Image per opératoire : Après mise en place du greffon de péricarde de Bœuf (Tutopatch®).
Figure 10 : Image per opératoire : Après mise en place du greffon de péricarde de Bœuf (Tutopatch®).
Un greffe pédiculée de conjonctive bulbaire a ensuite été suturée au Vicryl 9.0, par-dessus le biomatériau, de façon à renforcer le montage et à apporter, immédiatement, la vascularisation nécessaire à la cicatrisation (Cf. Figure 11).
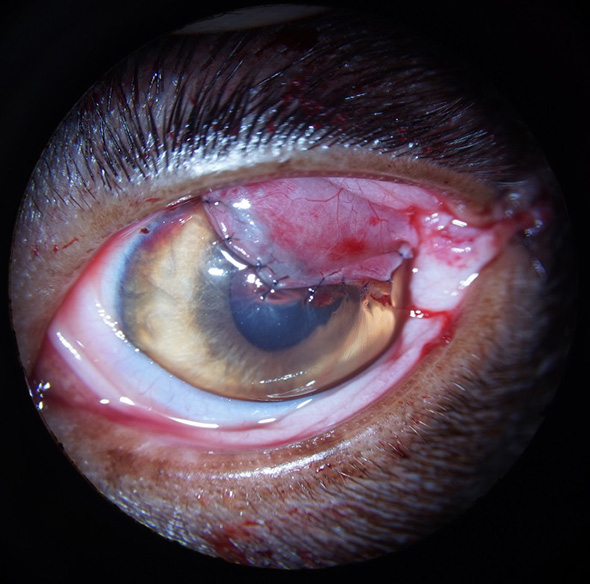 Figure 11 : Image per opératoire : Résultat en fin d’intervention. Noter la présence du greffon de conjonctive bulbaire, par-dessus celui de péricarde de Bœuf.
Figure 11 : Image per opératoire : Résultat en fin d’intervention. Noter la présence du greffon de conjonctive bulbaire, par-dessus celui de péricarde de Bœuf.
La canthotomie latérale a enfin été suturée en points simples au Vicryl 5.0. Le traitement post opératoire a consisté en l’administration locale et générale d’antibiotiques et en l’administration générale d’antiinflammatoires.
Evolution clinique
La chienne a été revue en contrôle une semaine après l’intervention. Le greffon était bien en place, aucune complication n’a été notée.
A la consultation de suivi, un mois après, le greffon était complètement impacté, l’examen ophtalmologique ne révélait aucune anomalie. L’évolution étant satisfaisante, aucun autre contrôle n’a été nécessaire ultérieurement. A ce jour, aucune récidive locale n’a été signalée.
- Analyse histologique :
A la fin de l’intervention, une analyse histologique de la pièce d’exérèse a été demandée. L’analyse a confirmé l’hypothèse de mélanocytome bénin ou mélanome épibulbaire (Cf. Figures 12 et 13).
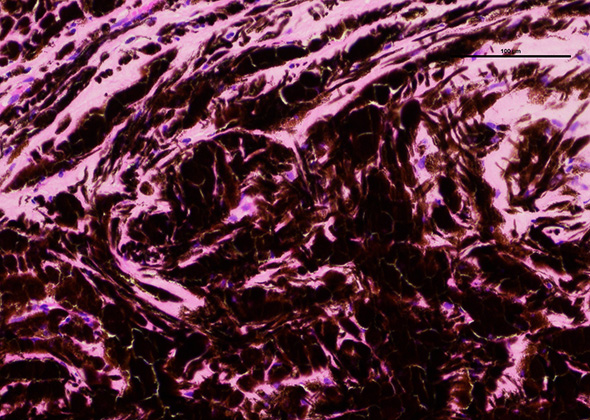 Figure 12 et 13 : Coupes histologiques de la masse, confirmation de l’hypothèse de mélanocytome bénin.
Figure 12 et 13 : Coupes histologiques de la masse, confirmation de l’hypothèse de mélanocytome bénin.
DISCUSSION
Les mélanomes épibulbaires canins sont généralement considérés comme bénins, néanmoins, ils peuvent avoir une extension intraoculaire avec une invasion de l’angle iridocornéen et des tissus de l’uvée antérieure dans 16% des cas (6, 7 ,8). De plus, l’étude Donaldson et al. 2006 décrit des caractéristiques histologiques de malignités, telles qu’une augmentation du taux de mitoses et de la nécrose tumorale, dans 5 cas sur 30 (2). Des études rétrospectives avaient, par le passé, montré que le comportement des tumeurs chez les jeunes patients (2-4 ans) était plus agressif avec une croissance rapide ainsi qu’un taux d’invasion intraoculaire plus important, que chez les chiens plus âgés (8-11 ans). Cependant, plus récemment, il a été mis en évidence des cas de progression rapide de mélanomes épibulbaires chez des animaux âgés, orientant le choix thérapeutique vers des procédures chirurgicales plus agressives quel que soit l’âge de l’animal.
Durant les dernières décennies, de nombreuses techniques de gestion chirurgicale des mélanomes limbiques ont été décrites. La résection totale de pleine épaisseur, des mélanomes épibulbaires, est l’option idéale pour minimiser le risque de récidives locales. Néanmoins, en raison de l’extension de certains mélanomes, envahissant toute l’épaisseur de la cornée jusqu’à la membrane de Descemet, ceci peut être difficile à réaliser et requiert une reconstruction cornéenne importante. Selon l’ampleur et l’épaisseur de la perte de substance, la reconstruction cornéenne peut se faire à l’aide de différentes greffes : utilisation de biomatériau, allogreffe cornéosclérale, ou autogreffe (5, 6, 8, 10, 11).
L’utilisation d’un biomatériau acellulaire (ex A-Cell, Tutopatch®, SIS) a l’avantage de sa biodisponibilité, de réduire les risque de rejet, et d’éviter les infections iatrogènes possibles avec les allogreffes 11. Néanmoins, du fait de leur épaisseur limitée, il y a un risque que le support tectonique ne soit pas adapté pour maintenir l’intégrité du globe. Par exemple, le SIS (matrice extracellulaire obtenu à partir de sous muqueuse intestinale porcine) a une épaisseur de 80 à 100µm alors que la cornée périphérique fait 0,5 à 0,6 mm d’épaisseur et la sclère 0,6 mm (6,8).
Les techniques d’autogreffes sont quant à elles intéressantes car elles permettent l’obtention d’un greffon facilement disponible sans recherche de donneur, elles minimisent les risques de rejet et les risques de transplantation de tissus infectés (5,8). Plusieurs types de greffons ont été décrits. Le cartilage de la membrane nictitante peut être utilisé pour des pertes de substances cornéosclérales de taille limitée (5), toutefois, le prélèvement du greffon peut altérer le fonctionnement de la membrane nictitante 6. Dans le cas d’une perte cornéosclérale importante, Mathes et al. 2015, ont utilisé, comme greffon, un morceau de cartilage de pavillon auriculaire avec l’avantage d’un bon support tectonique et d’une taille de greffon plus importante. Néanmoins, cette technique présente plusieurs désavantages : l’augmentation du temps d’anesthésie, l’abord d’un deuxième site opératoire, un greffon opaque pouvant compromettre la vision de l’animal et enfin une zone de prélèvement de greffe très innervée, nécessitant une analgésie per et post opératoire importante (8).
Enfin, la reconstruction cornéosclérale, peut se faire par allogreffe de matériel congelé. Les greffes cornéosclérales congelées ont l’avantage d’apporter un support tectonique immédiat avec une rigidité satisfaisante du globe, de nécessiter une seule anesthésie et de permettre de combler des pertes de substance de grande taille (6, 10). Par contre, ce type de greffe nécessite un stockage à -20 ou -80°C, les rendant moins disponibles en pratique, et le résultat visuel peut rester variable. En effet, dans l’étude Maggio et al. 2013, il y a eu une pigmentation ou une fibrose secondaire de la totalité des 11 greffes réalisées (6).
Bien que limitant fortement le risque de récidive, l’exérèse en bloc par sclérokératectomie perforante, peut être associée à de multiples complications : hémorragies intraoculaires, uvéites sévères, cataractes, synéchies, pouvant compromettre le pronostic visuel et l’intégrité des structures oculaires (1, 6). Par conséquent, de nombreuses études développent une approche de retrait partiel de la masse limbique, associé à un traitement adjuvant tel que la photocoagulation au laser, la radiothérapie au strontium-β ou encore la cryothérapie (1,3,4,10, 11).
L’étude de Donaldson et al. 2006, sur 30 chiens, présente une technique de résection lamellaire de mélanomes épibulbaires associée à une radiothérapie au strontium-β. Cette méthode apparaît très efficace avec un faible taux de récidive (3%), mais est associée à un fort taux de complications notamment des amincissements de la sclère. De plus, cette technique requiert de multiples anesthésies générales (3 au total dans le protocole décrit) et n’est pas facilement disponible au vu des implications de santé et de sécurité du personnel (Radioactive Substance Act, 1993 et Ionizing Regulations, 1999) (3).
Différentes études décrivent un traitement des mélanomes épibulbaires par photocoagulation au laser (Nd :YAG = Neodynium :yttrium-aluminium-garned / Laser diode) (1,11,12). Les lasers utilisés émettent une lumière proche du spectre infrarouge, qui est préférentiellement absorbée par les tissus contenant de la mélanine. L’énergie laser entraine alors une nécrose photocoagulative des tissus richement pigmentés (1, 11). En 1996, Sullivan et al, décrivent un traitement des mélanomes limbiques par photocoagulation au laser Nd :YAG seul. La morbidité est alors très faible. Par contre, cette technique est associée à un fort taux de récidive (20%), ce qui la rend peu intéressante (12). Une étude très récente, Andreani et al, 2016, a évalué l’efficacité et la morbidité de la photocoagulation au laser diode après exérèse partielle de 21 mélanomes limbiques canins. Cette technique paraît intéressante, surtout pour les cas où l’exérèse totale est rendue difficile par la taille de la masse, avec un taux de succès de plus de 80%. L’utilisation d’une énergie laser forte > 400J, pourrait limiter le nombre de récidive. Des complications sont notées dans cette étude, mais la plupart sont transitoires et ont été résolues par un traitement médical. On note néanmoins le développement d’une kératopathie bulleuse sur un chien traité deux fois par photocoagulation au laser diode, possible conséquence d’une inflammation stromale et de la destruction de la composition cornéenne lamellaire liée à la thérapie laser ; et le développement d’une cataracte mature d’origine inconnue. Les désavantages de cette technique sont le coût du matériel nécessaire et les possibilités de récidive (1).
Enfin, la dernière technique adjuvante à l’exérèse des mélanomes épibulbaires décrite dans la littérature est la cryothérapie. Les mélanocytes sont des cellules particulièrement sensibles à la cryothérapie de par leur forte concentration en eau. Deux cycles de congélation/décongélation sont nécessaires pour obtenir une rupture cellulaire 4, 10. L’étude Featherstone et al, 2009 a évalué l’efficacité et le taux de complication d’une résection lamellaire partielle de mélanomes épibulbaires canins suivie d’une cryothérapie sur 14 cas. Cette technique est intéressante dans la gestion des mélanomes limbiques, car elle est mini invasive, bien tolérée et efficace dans 100% des cas de l’étude. Néanmoins, une lipidose cornéenne marquée est une complication post opératoire à envisager suite à cette technique, surtout pour les mélanomes étendus (4,6). Cette kératopathie lipidique n’a toutefois qu’un impact mineur, les yeux traités étant voyants et non douloureux (4).
Dans notre cas clinique, l’extension intracornéenne laissait une portion saine de cornée de 0,36 mm sous le mélanome. L’exérèse totale de la masse a donc pu être réalisée par kératosclérectomie non perforante, aucune technique adjuvante n’a été réalisée. Pour combler la perte de substance cornéenne, une greffe de biomatériau a été utilisée, ici du Tutopatch® (pericarde bovin) choisi pour son épaisseur plus importante que les autres biomatériaux disponibles, apportant dans le cas présent un support tectonique satisfaisant. Une greffe conjonctivale pédiculée a été réalisée par-dessus la greffe de Tutopatch®, permettant de protéger celle-ci et d’apporter immédiatement de la vascularisation. Après plusieurs mois de suivi, le chien était voyant et n’a pas présenté de récidives.
RÉFÉRENCES BIBLIOGRAPHIQUES
- Andreani V. Guandalini A. D’Anna N. et al. The combined use of surgical debulking and diode laser photocoagulation for limbal melanoma treatment: a retrospective study of 21 dogs. Veterinary ophthalmology 2016; 1-8.
- Donaldson D. Sansom J. Scase T et al. Canine limbal melanoma: 30 cases (1992-2004). Part 1. Signalement, clinical and histological features and pedigree analysis. Veterinary ophthalmology 2006; 9: 115-119.
- Donaldson D. Sansom J. Adams V. Canine limbal melanoma: 30 cases (1992-2004). Part 2. Treatment with lamellar resection and adjunctive strontium-90β plesiotherapy-efficacy and morbidity. Veterinary ophthalmology 2006; 9: 179-185.
- Featherstone HJ. Renwick P. Heinrich CL. et al. Efficacy of lamellar resection, cryotherapy, and adjunctive grafting for the treatment of canine limbal melanoma. Veterinary ophthalmology 2009; 12(Suppl.1): 65-72.
- Kanai K., Kanemaki N. Matsuo S. et al. Excision of a feline limbal melanoma and use of nictitans cartilage to repair the resulting corneoscleral defect. Veterinary ophthalmology 2006; 9: 255-258.
- Maggio F. Pizzirani S. Pena T. et al. Surgical treatment of epibulbat melanocytomas by complete excision and homologous corneoscleral grafting in dogs : 11 cases. Veterinary ophthalmology 2013; 16: 56-64.
- Martin CL. Canine Epibulbar melanomas and their management. Journal of the American Animal Hospital Association 1981; 17: 83-90.
- Mathes RL. Moore PA. Ellis AE. Penetrating sclerokeratoplasty and autologous pinnal cartilage and conjunctival grafting to treat a large limbal melanoma in a dog. Veterinary ophthalmology 2015; 18: 152-159.
- Mc Mullen RJ. Clode AB. Pandiri AKR. et al. Epibulbar melanoma in a foal. Veterinary ophthalmology 2008; 11(Suppl. 1): 44-50.
- Norman JC. Urbanz JL. Calvarese ST. Penetrating keratoscleroplasty and bimodal grafting for treatment of melanocytoma in a dog. Veterinary ophthalmology 2008; 11: 340-345.
- Plummer CE. Kallberg ME. Ollivier FJ. et al. Use of biosynthetic material to repair the surgical defect following excision of an epibulbar melanoma in a cat. Veterinary ophthalmology 2008; 11: 250-254.
- Sullivan TC. Nasisse MP. Davidson MG. et al. Photocoagulation of limbal melanoma in dogs and cats: 15 cases (1989-1993). Journal of the American Veterinary Medical Association 1996; 208: 891-894.
