Bronchite vermineuse chez un Beagle mâle de 4 ans
Dr Julie BROSSARD, DMV – Dr Anne-Charlotte BARROT, DMV (CHV Saint-Martin)
Anamnèse
Un chien Beagle mâle de 4 ans est présenté pour une toux chronique depuis plusieurs mois. Il vit en chenil et chasse avec son maître. Il est correctement vacciné et vermifugé tous les 4 mois à l’aide de l’association de pyrantel et praziquantel.
L’animal a présenté une toux de chenil un an auparavant.
L’épisode de toux a commencé à l’automne, 3 mois avant la consultation au centre hospitalier. La toux est quinteuse et grasse avec beaucoup de mucosités. Une corticothérapie initiée par le vétérinaire traitant a permis d’améliorer les symptômes mais une rechute est systématiquement constatée à l’arrêt du traitement.
Examen clinique
L’animal présente un bon état général. Son score corporel est estimé à 2,5/5. L’animal est normotherme à 38,6°C. L’auscultation cardiaque révèle un souffle systolique basal gauche de grade II/VI. L’auscultation des champs pulmonaires est normale dans les 2 hémi-thorax.
Examens complémentaires
Des radiographies du thorax ont été réalisées par le vétérinaire traitant et n’ont révélé que la présence d’une opacité broncho-interstitielle modérée plus marquée dans les lobes caudaux compatible principalement avec une bronchopneumonie d’origine bactérienne, virale ou parasitaire, ou avec une pneumonie inflammatoire. Un corps étranger bronchique ne peut être exclu.
Un scanner est réalisé afin de qualifier plus précisément les lésions pulmonaires. Il permet de mettre en évidence un épaississement important et diffus de la paroi de l’ensemble des bronches plus marqué dans les lobes caudaux, caractérisant une bronchite chronique sévère.
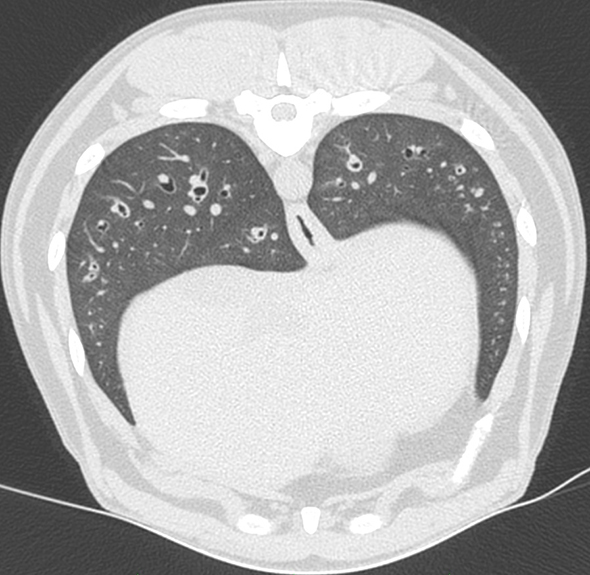
Examen scanner : épaississement de la paroi des bronches
Un lavage bronchoalvéolaire est réalisé sous contrôle endoscopique afin d’identifier l’origine des lésions.
Peu de lésions trachéales sont visibles. En revanche, dès l’approche de l’endoscope dans les grosses bronches de nombreux parasites blanchâtres sont visibles. Le liquide résultant du lavage est trouble, révèle du mucus en quantité modérée et plusieurs parasites blanchâtre d’une longueur variant entre 5 et 20 mm.
Le diagnostic de bronchite vermineuse est posé. Compte tenu de la localisation du parasite, de son aspect et des lésions observées une infestation par Crenosoma vulpisest fortement soupçonnée.

Parasites retirés lors de lavage bronchoalvéolaire

Parasites retirés lors de lavage bronchoalvéolaire
Traitement
Une vermifugation à base de fenbendazole (Panacur®) à 50mg/kg sur 5 jours a été mis en place associée à une corticothérapie à dose anti-inflammatoire afin de prévenir des réactions d’hypersensibilité liées à la mort massive des parasites. Une hospitalisation a été proposée mais refusée par le propriétaire.
Suivi
Un mois après la fin du traitement, l’animal ne présente plus de toux et mange avec appétit. Son état général est bon et aucune anomalie n’est révélée par l’examen clinique.
DISCUSSION
Les parasitoses cardiopulmonaires : des maladies émergentes au diagnostic difficile.
Les parasitoses cardiopulmonaires du chien sont aujourd’hui considérées comme émergentes en Europe. Les causes ayant conduit à leur émergence ne sont pas connues mais les mouvements de population et le réchauffement climatique semblent y participer. Le probable sous diagnostic de ces affections durant les dernières années peut aussi amplifier cette idée [1].
Les principaux parasites cardiorespiratoires retrouvés en France sont Dirofilaria immitiset Angiostrongylus vasorum. Cependant, d’autres parasites, comme Crenosoma vulpisou Oslerus osleri, peuvent être rencontrés et leur prévalence est sans doute encore sous estimée.
Nous nous concentrerons plus particulièrement sur l’infestation par Crenosoma vulpiscompte-tenu de l’identification du parasite chez notre chien.
Généralités sur le parasite
Crenosoma vulpis est un nématode de l’ordre des Strongylidés. Les chiens et les renards sont infestés par ce parasite en ingérant des limaces ou des escargots qui sont des hôtes intermédiaires et hébergent la larve L3. Après migration depuis le tube digestif et via le coeur, l’adulte vit dans la lumière de la partie distale des bronches et des premières bronchioles. Les adultes pondent des œufs qui deviennent des larves de stade 1 qui sont dégluties et émises dans l’environnement via les fèces [2] [3].
Importance de l’historique et de l’examen clinique de l’animal
Le cycle de C. vulpis fait donc intervenir un hôte intermédiaire de type mollusque, c’est pourquoi les infestations par ce parasite sont souvent observées chez les chiens vivant à l’extérieur ou participant à la chasse comme ce fut le cas pour notre chien. Le mode de vie est un paramètre à ne pas négliger lorsque nous nous trouvons face à une atteinte cardiorespiratoire [3].
Les signes cliniques assez classiques sont sûrement responsables du sous diagnostic de ces maladies parasitaires. En effet, ces signes peuvent être frustres, peu spécifiques et évoquer d’autres pathologies respiratoires (toux, jetage, tachypnée, intolérance à l’effort,…). Une atteinte respiratoire plus importante peut être observée lors de surinfections bactériennes [2].
Ces signes frustres conduisent souvent les praticiens à essayer en première intention un traitement probabiliste (antibiothérapie et/ou corticothérapie) qui peut améliorer temporairement les symptômes et le conduire à classer la maladie comme une bronchite allergique ou une bronchopneumopathie bactérienne récidivante. Dans notre cas, les signes cliniques se sont effectivement améliorés temporairement.
Choix des examens complémentaires
L’analyse du milieu de vie et de la clinique est un élément à ne pas négliger mais le diagnostic définitif repose sur la réalisation d’examens complémentaires.
La numération formule peut apporter quelques indices (possible anémie et/ou éosinophilie) mais les changements sont souvent inconstants et peu spécifiques [3].
La radiographie thoracique révèle souvent un pattern broncho-interstitiel ou alvéolaire peu spécifique. Parfois aucune lésion n’est observée [4], [5]. Cet examen peut cependant être intéressant pour suivre l’évolution de la maladie.
La bronchoscopie est un examen complémentaire à ne pas négliger. En effet, l’endoscopie des voies respiratoires permet de visualiser directement les lésions, de les caractériser mais aussi de cibler le lieu d’un lavage broncho-alvéolaire (LBA) sur lequel un examen cytologique et bactériologique pourra être effectué. Lors d’infestation par C. vulpis des lésions d’inflammation bronchiques avec production de mucus en quantité importante sont observables. Le liquide du LBA est trouble, parfois teinté de sang et des adultes peuvent dans certains cas être observés comme pour notre chien. Dans ce cas le diagnostic est rapidement posé (sans l’envoi des analyses). Si les adultes ne sont pas visibles l’examen microscopique du liquide de lavage révèle des larves de stade 1 dans tous les cas de chiens infestés [2] [3] [6] [7].
Il est également possible d’identifier les parasites en réalisant une coproscopie de Baerman sur des selles récoltées pendant 3 jours. Cette méthode est également très sensible mais des faux négatifs sont possibles.
Notons qu’il est également possible aujourd’hui de diagnostiquer certaines parasitoses par des test ELISA, comme c’est le cas pour l’angiostrongylose. Ce type de test n’est cependant pas disponible pour la détection de C. vulpis. [8]
RÉFÉRENCES BIBLIOGRAPHIQUES
- Traversa D. Di Cesare A., Conboy G., (2010) Canine and feline cardiopulmonary parasitic nematodes in Europe: emerging and underestimated. Parasites & Vectors, 3:62
- Bergeaud P., Les parasitoses pulmonaires du chien
- Guillot M., (2008), Aide au diagnostic par une étude comparative des principales parasitoses cardio-circulatoires et respiratoires des carnivores domestiques, Thèse pour l’obtention du grade de docteur vétérinaire. Lyon.
- Nelson R., Couto G., (2009) Disorder in the pulmonary parenchyma and vasculature(chapitre 22), in Small animal internal medicine 4th édition, 307-308
- Maï W. et al, The lung parenchyma (Chapter 12) in BSAVA Manual of canine and féline thoracic Imaging p307-8
- McKiernan B.C., (2005), Veterinary endoscopy for the small animal practitioner, chapter 6 Bronchoscopy, p201-227
- Andreasen C.B., (2003) Bronchoalveolar lavage in Vet Clin Small Anim 33 69–88
- Schnyder et al., (2011) An ELISA for sensitive and specific detection of circulating antigen of Angiostrongylus vasorum in serum samples of naturally and experimentally infected dogs, in Veterinary Parasitology 179, 152–158

