À propos de la greffe conjonctivale bipédiculée
Dr Thomas DULAURENT, Dr Pierre-François ISARD (CHV Saint-Martin)
De nombreuses atteintes cornéennes requièrent la réalisation d’une chirurgie de greffe conjonctivale chez les carnivores domestiques comme chez le cheval. Citons les ulcères profonds, les infections bactériennes ou fongiques, les séquestres cornéens… La chirurgie consiste en l’ablation de la cornée affectée et en son remplacement par de la conjonctive bulbaire.
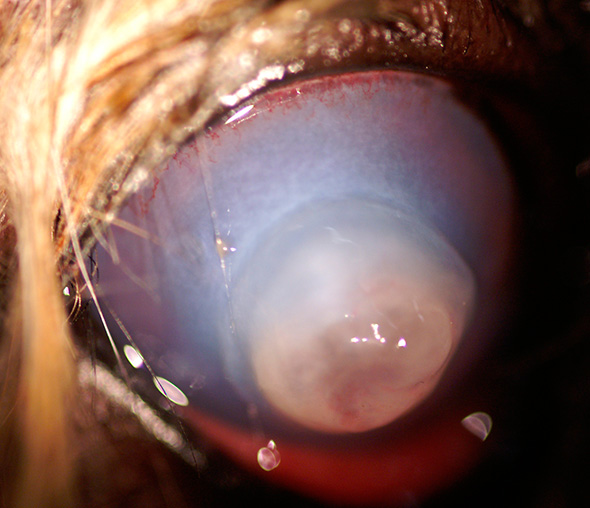
Descemetocoele étendue chez un chien
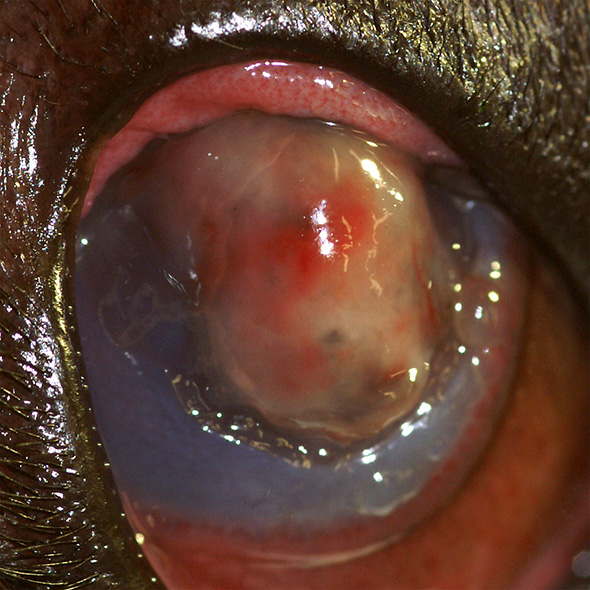
Iridocoele étendue chez un chien
Il existe de nombreux types de greffe de conjonctive: greffe en ilot, greffe pédiculée par rotation ou par translation, greffe par glissement, greffe bipédiculée….
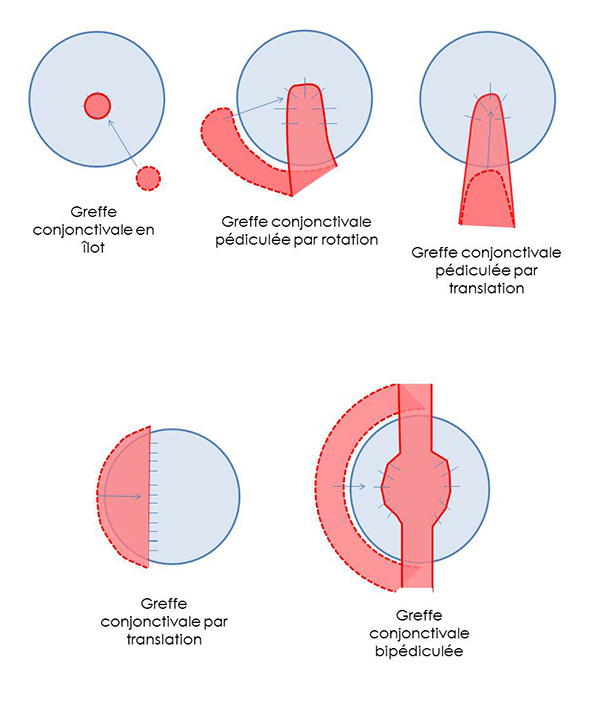
Les différents types de greffes conjonctivales
La greffe la plus fréquemment réalisée est la greffe conjonctivale pédiculée. Dans certains cas cependant, la perte de substance cornéenne est tellement vaste que cette greffe n’est pas adaptée. Pour ces cas-là, la greffe bipédiculée semble plus indiquée. Les avantages qu’elle offre sont une meilleure répartition des tensions sur le greffon de conjonctive par tractions opposées sur chaque pédicule, une capacité de recouvrement supérieure.
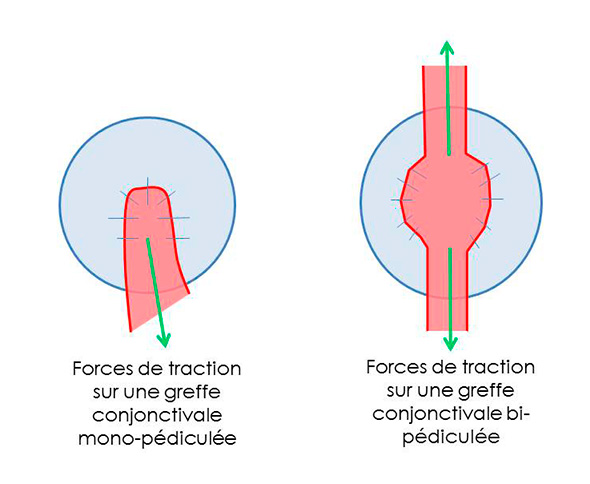
Forces de traction sur greffe pédiculée et greffe bipédiculée
La greffe bipédiculée est aussi particulièrement adaptée chez le cheval (photographie 1) pour lequel les pertes de substances sont souvent étendues. La conjonctive des équidés étant par ailleurs beaucoup plus fragile que celle des carnivores, la présence de deux pédicules offre de meilleures capacités de résistance à la traction que lors d’une greffe monopédiculée.
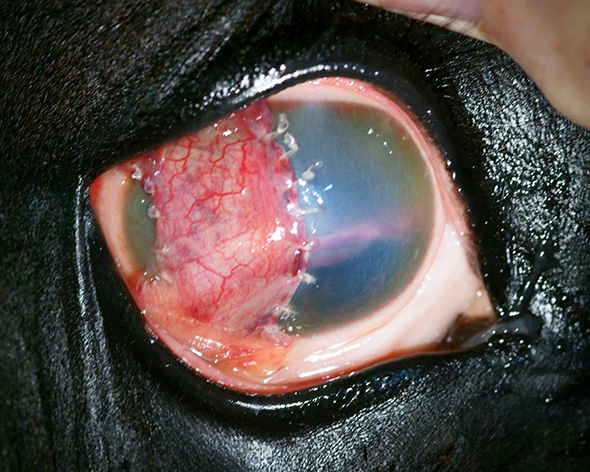
Greffe conjonctivale bipédiculée chez un cheval
La greffe bipédiculée nous semble donc une technique intéressante à prendre en compte dans la gestion de certaines affections cornéennes, tant chez les carnivores que chez les équidés.
QUESTIONS
1 . Quel est le diagnostic différentiel de l’azotémie ?
Quels sont les éléments de l’anamnèse, des commémoratifs et de l’examen clinique permettant de suspecter un hypocorticisme (ou maladie d’Addison) chez ce chien ?
2 . Quels examens complémentaires proposez-vous dans notre cas ? Quel examen complémentaire permettrait d’orienter notre diagnostic vers un hypocorticisme ?
3 . Quels tests permettent de confirmer un hypocorticisme ?
Comment déterminer le diagnostic étiologique (hypocorticisme primaire ou secondaire) ?
4 . Quel traitement proposez-vous ?
RÉPONSES
1 . Quel est le diagnostic différentiel de l’azotémie ? Quels sont les éléments de l’anamnèse, des commémoratifs et de l’examen clinique permettant de suspecter un hypocorticisme (ou maladie d’Addison) chez ce chien ?
L’azotémie peut être d’origine pré-rénale (notamment lors d’une baisse de la perfusion rénale : déshydratation, état de choc secondaire notamment à un AVP ou un hypocorticisme…), rénale (aigue ou chronique) ou post-rénale (obstruction vésicale, urétérale ou urétrale, uro-abdomen). Notons qu’une augmentation proportionnellement plus importante de l’urée que de la créatinine traduit souvent des saignements digestifs (rencontrés notamment lors d’insuffisance rénale ou d’hypocorticisme).
Chez notre patient, plusieurs points sont en faveur d’un hypocorticisme :
- l’âge de l’animal (4 ans) correspond à l’âge moyen de diagnostic de maladie d’Addison (entre 4 et 6 ans selon les études)
- l’abattement et l’anorexie sont des symptômes très généraux mais que l’on retrouve chez les animaux addisoniens du fait du déficit en glucocorticoïdes
- les vomissements peuvent être retrouvés lors d’insuffisance rénale mais aussi lors d’hypocorticisme. Le mécanisme exact des cas de gastrite observés lors de cette maladie reste vague. Des troubles de la motricité digestive sont rapportés chez ces patients ; ils sont attribués en partie aux déséquilibres électrolytiques responsables des anomalies de conduction nerveuse et neuro-musculaire, mais aussi indirectement à la baisse de la cortisolémie. De plus, des lésions gastriques consécutives à un défaut de vascularisation de la paroi gastrique en raison de l’hypovolémie sont parfois présentes.
- l’hypothermie peut être observée chez les animaux addisoniens et est souvent présente lors d’hypovolémie.
- l’hypoglycémie est également en faveur d’un hypocorticisme. Elle s’explique par un manque de la néoglucogenèse en raison du déficit en cortisol (le cortisol stimule normalement la néoglucogénèse hépatique en augmentant la synthèse des enzymes nécessaires à sa réalisation et en permettant la mobilisation des acides aminés dans tous les tissus autres que le foie).
- les épisodes de malpropreté rapportés par les propriétaires peuvent correspondre à une polyurie-polydipsie, parfois observée lors d’hypocorticisme due à la déficience en minéralocorticoïde.
En revanche, il semblerait que les femelles soient plus souvent touchées que les mâles (environ 70% des cas sont des femelles).
2 . Quels examens complémentaires proposez-vous dans notre cas ? Quel examen complémentaire permettrait d’orienter notre diagnostic vers un hypocorticisme ?
Une analyse biochimique est nécessaire pour suivre l’évolution des paramètres rénaux : ici l’azotémie mise en évidence lors des premiers examens n’est plus présente.
Une analyse urinaire est intéressante pour plusieurs points. Tout d’abord, une densité urinaire élevée permet d’exclure une insuffisance rénale vraie. Ici la densité est de 1,015 ce qui ne permet pas de conclure. L’analyse du culot urinaire permet également de mettre en évidence d’éventuels cristaux ou bactéries, non observés dans notre cas.
Un ionogramme est utile en cas de suspicion d’hypocorticisme. En effet, l’hypoaldostéronisme engendre un défaut de réabsorption du sodium et du chlore qui s’échangent avec le potassium au niveau du tube contourné distal. Notons cependant que lorsque l’animal a déjà reçu une fluidothérapie avant la réalisation du ionogramme (comme c’est le cas ici), et que celui-ci est normal, il est difficile d’exclure un hypocorticisme (les valeurs du ionogramme ont pu se normaliser avec la perfusion). Ici le ionogramme montre une hyperkaliémie (5,9 mmol/L ; valeurs usuelles entre 3,5 et 5,8 mmol/L) associée à une hyponatrémie (119 mmol/L ; valeurs usuelles entre 144 et 160 mmol/L) et une hypochlorémie (98 mmol/L ; valeurs usuelles entre 109 et 122 mmol/L), en faveur d’un hypocorticisme. Ces modifications peuvent également être objectivées par le rapport Na/K : un rapport Na/K entre 19 et 26 est compatible avec un hypocorticisme, un rapport Na/K < 19 est très en faveur. Ici le rapport est de 20, ce qui oriente fortement le diagnostic. Cependant, ce seul rapport ne permet pas de poser le diagnostic définitif.
3 . Quels tests permettent de confirmer un hypocorticisme ?
Comment déterminer le diagnostic étiologique (hypocorticisme primaire ou secondaire) ?
L’hypocorticisme peut avoir plusieurs origines : il est dans la grande majorité des cas primaire, c’est-à-dire résultant d’une atrophie idiopathique des glandes surrénales. Cette destruction touche en général simultanément les différentes couches de la corticosurrénale provoquant une insuffisance surrénalienne complète (touchant les différentes zones du cortex surrénalien). Le mécanisme est mal connu mais une médiation immune est suspectée. De rares cas d’origine primaire peuvent avoir une déficience uniquement en glucocorticoïde souvent au début de la maladie. Beaucoup plus rarement, l’hypocorticisme peut être secondaire (ou central) avec une atteinte hypophysaire (tumeur, inflammation, traumatisme…) entrainant un déficit de production d’ACTH d’où un déficit en glucocorticoïdes avec conservation de la sécrétion de minéralocorticoïdes.
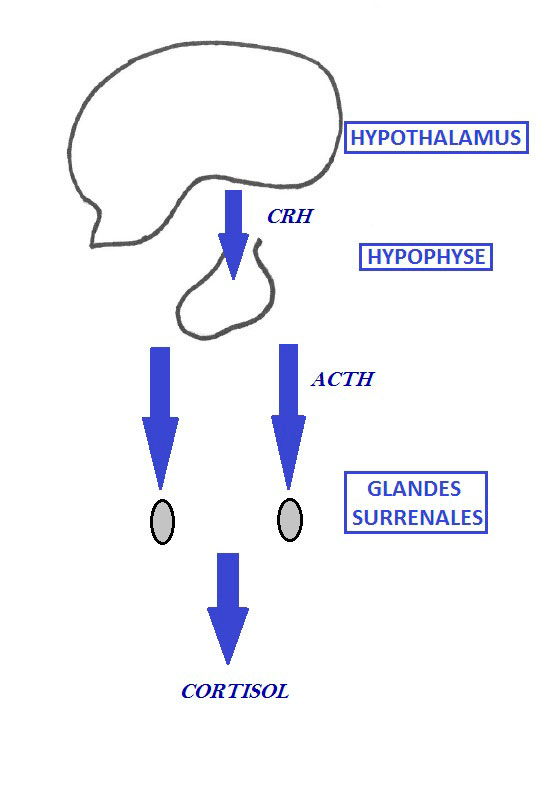
Axe fonctionnel hypothalamo-hypophysaire
La confirmation d’un hypocorticisme passe par des dosages hormonaux. Le test de stimulation à l’ACTH est le test de référence et est très couramment utilisé. Il permet d’évaluer fonctionnellement le cortex surrénalien en appréciant ses réserves en stéroïdes. Le cortisol basal est dosé juste avant la stimulation, puis l’ACTH est injectée par voie intra veineuse ou intramusculaire (Synacthène®), et un nouveau dosage de cortisol est réalisé 1 heure après la stimulation. Si la cortisolémie post-stimulation est inférieure à 55 nmol/L, le diagnostic est confirmé. Notons qu’une cortisolémie basale supérieure à 55 nmol/L exclu un hypocorticisme (dans ce cas, le test de stimulation à l’ACTH n’est pas nécessaire).
Ce test présente l’avantage d’être rapide et facile à mettre en place, sa spécificité et sa sensibilité sont de plus excellentes. Notons que le dosage seul de la cortisolémie basale est insuffisant pour conclure puisqu’il existe un recouvrement entre les valeurs de cortisolémie basale chez l’animal sain et l’animal addisonien.
Dans le cas de notre chien, le test de stimulation à l’ACTH confirme bien l’hypothèse d’hypocorticisme : les cortisolémies basale et post-stimulation sont inférieures à 14 nmol/L.
En revanche, le test de stimulation à l’ACTH évalue seulement la capacité du cortex surrénalien à produire des glucocorticoïdes, et ne permet donc pas de déterminer l’étiologie de l’hypocorticisme (primaire ou secondaire). Dans la plupart des cas, la déficience en minéralocorticoïdes est déduite des anomalies de concentration en potassium et sodium mises en évidence avec l’ionogramme. Mais il n’est pas toujours évident de déterminer si une supplémentation en minéralocorticoïdes sera nécessaire ou non lorsque l’ionogramme est normal, dans le futur. Ainsi la mesure de la concentration plasmatique en ACTH peut être utile pour déterminer l’origine de l’hypocorticisme et donc peut aider le clinicien dans la mise en place du traitement adapté. Lors d’hypocorticisme primaire, la concentration en ACTH sera très élevée puisque le cortisol n’exerce pas son rétrocontrôle négatif. Au contraire lors d’hypocorticisme secondaire, la concentration en ACTH sera faible. Les valeurs usuelles de l’ACTH plasmatique varient entre 10 et 80 pg/mL. Cependant, ce dosage nécessite des conditions particulières de prélèvement : le prélèvement doit être fait sur un tube EDTA en silicone (le verre fixe l’ACTH) puis congelé très rapidement. Il existe des cas particuliers pour lesquels l’ACTH est élevé (indiquant un hypocorticisme primaire donc impliquant à la fois les glucocorticoides et les minéralocorticoïdes) mais qu’aucune anomalie n’est observée au ionogramme : il s’agit d’un hypocorticisme primaire atypique où seul le déficit en glucocorticoïdes est présent. La zone glomérulé est épargnée au moins au début de la maladie, un déficit en minéralocorticoïdes peut apparaître plus tardivement.
Les mesures du ratio cortisolémie/concentration plasmatique en ACTH et du ratio aldosteronémie/activité rénine plasmatique peuvent également être intéressantes : ces deux ratios sont en effet effondrés chez les animaux malades. De plus, le ratio aldosteronémie/activité rénine plasmatique permet d’évaluer la fonction minéralocorticoïde des glandes surrénales (ce que ne permet pas le test de stimulation à l’ACTH). Cependant, ces tests sont très onéreux et peu de laboratoires les proposent.
4 . Quel traitement proposez-vous ?
Prise en charge dans l’urgence (avant la confirmation)
Lorsqu’un hypocorticisme est fortement suspecté (sur la base des signes cliniques et des résultats des examens complémentaires) mais pas encore confirmé, un traitement d’urgence doit être mis en place sans risquer d’affecter les résultats des tests de confirmation.
Une hypovolémie est très souvent présente du fait du déficit en minéralocortocoïdes (la cause la plus fréquente de décès par crise addisonienne est le choc hypovolémique). Elle doit donc être corrigée le plus rapidement possible avec une fluidothérapie agressive pour remplir le compartiment vasculaire et améliorer la perfusion tissulaire. Notons que le NaCl 0,9% est un très bon choix pour son apport de sodium et de chlore, il contient également moins de potassium que le Ringer Lactate.
Si une hypoglycémie est présente, elle doit être corrigée selon la valeur de la glycémie (bolus de glucose souvent associé à une supplémentation dans la poche de perfusion). Dans notre cas, la glycémie s’était normalisée lors de l’admission du chien au CHV.
Les désordres électrolytiques (en particulier l’hyperkaliémie et l’acidose métabolique) doivent être corrigés s’ils sont sévères. Très souvent, la fluidothérapie seule est suffisante pour gérer l’acidose, mais l’hyperkaliémie nécessite un traitement supplémentaire dans un certain nombre de cas.
Si des glucocorticoïdes sont nécessaires en urgence : l’utilisation de la dexamethasone est à privilégier non seulement car elle agit rapidement, mais surtout car elle est la seule à ne pas interférer avec le test de stimulation à l’ACTH.
Traitement à long terme (après avoir réalisé le test de confirmation)
L’hypocorticisme doit être confirmé rapidement une fois l’animal stabilisé.
Le traitement à long terme associe une supplémentation en glucocorticoïdes et en minéralocorticoïdes :
Substitution en glucocorticoïdes : la prednisolone est utilisée par voie orale à la dose de 0,1 à 0,22 mg/kg deux fois par jour. L’objectif est de trouver la dose efficace la plus faible afin d’éviter au maximum les effets secondaires.
Substitution en minéralocorticoïdes : la DOCP (privalate de désoxycorticostérone, Percorten ND) a un effet minéralocortocoïde de 1 à 3% de celle de l’aldostérone mais elle n’est pas disponible en France.
Substitution mixte : la fludrocortisone est la molécule habituellement utilisée. Elle présente une activité minéralocorticoïde et glucocorticoïde. Le désavantage de cette molécule réside dans le fait qu’il est impossible d’ajuster de façon indépendante les doses de glucocorticoïdes et de minéralocorticoïdes. Notons que souvent, l’effet glucocorticoïde de cette molécule suffit et que donc il n’est pas toujours utile de complémenter l’animal sous fludrocortisone en glucocortocoïdes (risque de surdosage et donc d’effets secondaires).
Dans le cas de notre chien, un traitement à base de fludrocortisone et prednisolone a été instauré.
Un suivi tous les mois est conseillé durant 3 à 6 mois, puis un contrôle tous les 3-4 mois est suffisant une fois l’animal stabilisé. Une fois la crise sous contrôle, le pronostic est excellent à long terme.
RÉFÉRENCES BIBLIOGRAPHIQUES
- Peiffer R, Gelatt K, Gwin R. Tarsoconjunctival pedicle grafts for deep ulceration in the dog and cat. Journal of American Animal Hospital Association 1977; 13: 387-391.
- Kuhns EL. Conjunctival patch grafts for the treatment of corneal lesions in dogs. Modern Veterinary Practice 1979; 60: 301-305.
- Hakanson NE, Merideth RE. Conjunctival pedicle grafting in the treatment of corneal ulcers in the dog and cat. Journal of the American Animal Hospital Association 1987; 23: 641-648.
- Hakanson NE, Lorimer D, Merideth RE. Further comments on conjunctival pedicle grafting in the treatment of corneal ulcers in the dog and cat. Journal of the American Animal Hospital Association 1987; 24: 602-605.
